2023-03-15 来源 : IO笔记

文章中的很多观点,对免疫治疗时代,临床研究结果的解读很有帮助和启发。
笔记回顾如下:

“阳性”临床试验需要考虑的几个关键问题
通常,主要研究终点得到阳性结果是新药上市申请得以批准的重要前提,但仅有这一前提就足够了吗?
研究结果是否能够改变临床实践,需要对研究结果进行深度解读,并需要得到早期相关临床试验结果的支持。
充分考虑以下几个问题,有助于判断哪些临床研究结果有可能改变临床实践(表1)。

问题一:P<0.05就足够好吗? 问题二、临床获益程度有多大? 问题三、临床上,这一主要研究终点重要吗? 问题四、获得次要研究终点的支持了吗? 问题五、重要的亚组获益一致吗? 问题六、样本含量足够大?结论足够可信吗? 问题七、研究被提前终止了吗? 问题八、安全性问题会抵消获益吗? 问题九、疗效及安全性的均衡是患者特异性的吗? 问题十、研究设计及执行存在缺陷吗? 问题十一、研究结果适用于我的患者吗? |
问题一:P<0.05就足够好吗?
P=0.05意味着研究有5%的可能得到的是假阳性结果。
如果一项临床研究旨在为合理的争议提供非常确凿的证据,P值应当更小,通常P<0.001。类似如下研究:

问题二、获益程度有多大?
除了统计学意义,临床意义同样重要。临床获益需要在相对水平(例如HR值)及绝对水平(例如经过一段时间随访后的事件率等)进行衡量。
此外,还需要基于95%可信区间来表征获益的不确定程度。例如,当P值接近0.05的时候,其95%可信区间上限接近1,大于点估计水平。
下图:Keynote-604研究OS结果
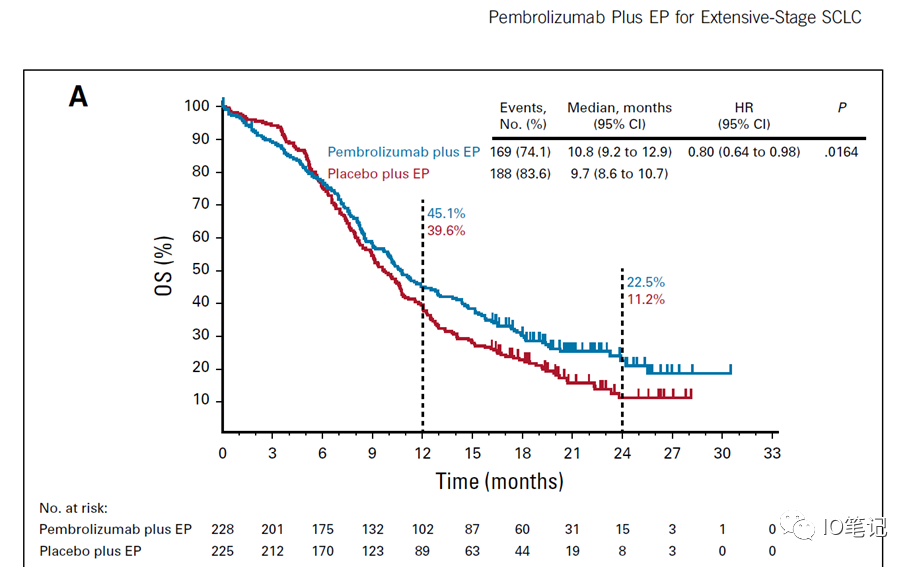
问题三、临床上,这一主要研究终点重要吗?
在某些情况下,替代终点是可以被接受的(如早期肺癌Checkmate-816研究的pCR(完全病理缓解)等)。

816研究OS数据:
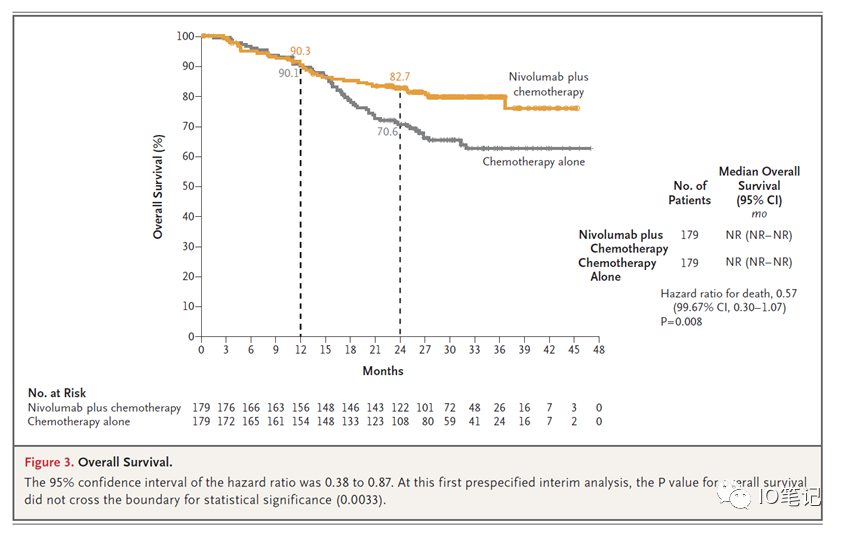
问题四、获得次要研究终点的支持了吗?
当预设的次要研究终点同样显示获益的时候,宣称研究为“阳性”的底气会更足;相反,如果次要研究终点未显示有获益,则争议就会随之产生。



问题五、重要的亚组获益一致吗?
不同临床病理特点的患者获益可能并不一致。有时候,不同亚组的患者均观察到获益或者获益的趋势,且在某些高危的亚组中获益更为显著。
816研究:


问题六、样本含量足够大?结论足够可信吗?
当一项小型的临床研究主要研究终点得到统计学阳性结果的时候,需要谨慎解读结果。
通常,小型临床试验缺乏足够的把握度并夸大治疗效果,因此,假阳性结果也就不可避免。
、

问题七、研究被提前终止了吗?
若一项临床试验显示了压倒性优势,通常会被提前终止,不幸的是,这一操作通常可能扩大疗效。随着试验的进行,两组实际的治疗效应可能会有相应的改变。
如果中期分析是基于高度可能的获益迹象做出的,则可能达到提前终止的标准并说服独立数据监察委员会新的治疗策略存在巨大获益。
此外,早期终止临床试验可能会降低重要次要研究终点(如安全性)的质量。


问题八、安全性问题会抵消获益吗?
当一种治疗手段可以带来显著获益的时候,需要考虑的一个问题就是研究带来的获益会被安全性问题抵消吗?
研究需要提供充分的数据以证明风险与获益是匹配的。临床获益人群与暴露于风险中的人群比较,可提供净获益人群的信息。

问题九、疗效及安全性的均衡是患者特异性的吗?
治疗方案多带来的净获益应当是患者特异性的——也就是说,针对那些有多重危险因素的患者,治疗是值得的,但是,就出现不良反应的患者而言,治疗是有害的。
目前,并没有简单直接的办法对患者的风险及获益进行衡量,建立统计模型可能有帮助。
问题十、研究设计及执行存在缺陷吗?
主要研究结果高度显著与研究结果被充分证实并排除是偶然因素导致的阳性发现,两者之间还有很长的一段路要走。
在承认研究带来的临床获益之前,设计及执行阶段的偏倚需要被充分考虑。
问题十一、研究结果适用于我的患者吗?
严格来说,任何一项临床试验的结果仅仅适用于与纳入临床试验特点一致的患者。研究结论是否可以外推到其他患者中需要进一步考虑。
地理位置的代表性同样影响到研究结论的普适性。很多大型临床研究都是国际多中心的,这有助于将治疗方案推向全球,但是不同地域的健康照护可能存在差异,如果患者招募主要集中在某个局部地区,那么治疗策略向全球推广可能就不适合。
讨 论:

P<0.05只是一项“阳性”临床试验最基本的要求,需要对其研究结果及研究过程进行全面、细致的审查。
研究数据到底是为医学实践提供了充分的证据还是要被审慎解读并需要被进一步证实,需要结合所有可获得的证据进行仔细考虑。
如果一项临床试验的疗效及安全性数据都令人信服,那么下一步要做的就是评估研究质量并进行内部验证,并且还要考虑在真实世界中是否同样有效。
对于一款新药而言,能否使监管部门满意并获得药物批准上市取决于证据的完整性。通常,监管部门会要求充分说明药物的安全性问题,而药物是否上市则取决于申办方是否愿意承担额外的安全性研究。
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)