2023-07-21 来源 : 臻和基因
不知不觉2023年已过半,国际和国内有不少抗癌新药获批上市。
本期我们将从以下两个方面进行介绍:
1、历年FDA批准的肿瘤免疫药物和适应症合集
2、2023年1-6月获批的肿瘤药物及适应症
历年FDA批准的肿瘤免疫药物
及适应症合集
今年上半年,有3个免疫治疗适应症获批,分别是帕博利珠单抗用于辅助治疗NSCLC和尿路上皮癌患者、新药retifanlimab-dlwr(Zynyz,瑞弗利单抗)第五款PD-1抑制剂用于治疗Merkel细胞癌成人患者。
下面一起来了解历年FDA批准的肿瘤免疫药物及适应症(图很好,值得收藏)。

注:标“星”是2023年上半年新增。
2023年1-6月FDA批准的
肿瘤药物及适应症
据公开资料显示,2023年上半年FDA共批准了17种抗肿瘤药物(5款新药)/联合用药方案,涉及11个癌种的16项适应症(包括加速批准适应症6项),另有1个适应症(子宫内膜癌)由“加速批准”转为 “常规批准”。
同期相比,今年乳腺癌获批的适应症占比升高,为18.75%(3/16)。
接下来将按照肿瘤部位对新获批的所有肿瘤药物及适应症进行详细介绍。
肺

该适应症为Pembrolizumab治疗NSCLC的第五项获FDA批准的适应症。疗效数据显示,Pembrolizumab治疗组的中位DFS为58.7个月,将疾病复发或死亡风险降低27%。Pembrolizumab是继2021年获批的Atezolizumab之后,第二种获批用于该适应症的免疫检查点抑制剂。
肠

Tucatinib联合Trastuzumab是FDA批准的首个治疗HER2阳性转移性结直肠癌的靶向联合疗法。疗效数据结果显示,接受组合疗法治疗的患者ORR为38.1%,中位DoR为12.4个月。中位PFS为8.2个月,中位OS为24.1个月。Tucatinib于2020年被批准用于治疗HER2阳性转移性乳腺癌。
乳腺

Elacestrant是首款获批的口服、可用于2线和3线 ER+/HER2-乳腺癌的雌激素受体抑制剂。疗效数据显示,在有ESR1突变的患者中,Elacestrant组的中位PFS为3.8个月,将疾病复发或死亡风险降低45%。Elacestrant是第二个获批的雌激素受体。
Sacituzumab govitecan-hziy是全球首个且唯一获批的靶向Trop-2的ADC类药物。疗效数据显示,Sacituzumab govitecan-hziy治疗组的中位PFS为5.5个月,中位OS为14.4个月,患者疾病进展或死亡风险下降34%,一年内PFS率为21%。Sacituzumab govitecan-hziy于2020年批准用于治疗转移性三阴性乳腺癌。
疗效数据显示:Abemaciclib联合内分泌治疗组的48个月IDFS率为85.5%,总生存数据仍不成熟。Abemaciclib于2021年10月12日批准联合内分泌疗法,用于辅助治疗HR+、HER2-的,存在淋巴结转移、复发风险高且Ki-67评分≥20%的,术后早期乳腺癌患者。
泌尿系

Enfortumab vedotin-ejfv联合Pembrolizumab的是首个获FDA批准用于治疗顺铂不耐受的局部晚期或转移性尿路上皮癌成年患者的ADC+PD-1抗体组合疗法,疗效数据显示,联合治疗组ORR为68%,CR为12%,PR为55%。Enfortumab vedotin-ejfv是首个获得FDA批准的Nectin-4定向抗体-药物偶联物(ADC) 。Enfortumab vedotin-ejfv于2019年12月18日,单药获批用于先前已接受PD-1/PD-L1抑制剂治疗的局部晚期或转移性尿路上皮癌成年患者。此次获批是Pembrolizumab 治疗尿路上皮癌的第三项获批适应症。
神经系统

Dabrafenib联合Trametinib成为首个获批用于治疗BRAF V600E LGG儿童患者的联合靶向疗法。此外,FDA还批准了这两种药物的新口服制剂,适用于无法吞咽药片的患者。疗效数据显示,接受该联合疗法的患者ORR为46.6% ,中位DoR为23.7个月,中位PFS为20.1个月。
皮肤

Retifanlimab-dlwr是首个获批的第五款PD-1抑制剂。疗效数据显示, Retifanlimab-dlwr单药治疗组的ORR为52%,CR为18%,PR为34%。在获得缓解的患者中,76%(26/34)的患者DoR为6个月及以上,62%(21/34)的患者DoR为12个月及以上。此适应症的获批扩大了用于治疗Merkel细胞癌的ICI产品组合,其他可用于治疗Merkel细胞癌的药物有avelumab和pembrolizumab。
女性生殖系

2021年8月Dostarlimab-gxly已获FDA批准用于治疗dMMR的复发或晚期实体瘤成年患者,是第四款获批上市的实体瘤“广谱抗癌药”。
男性生殖系
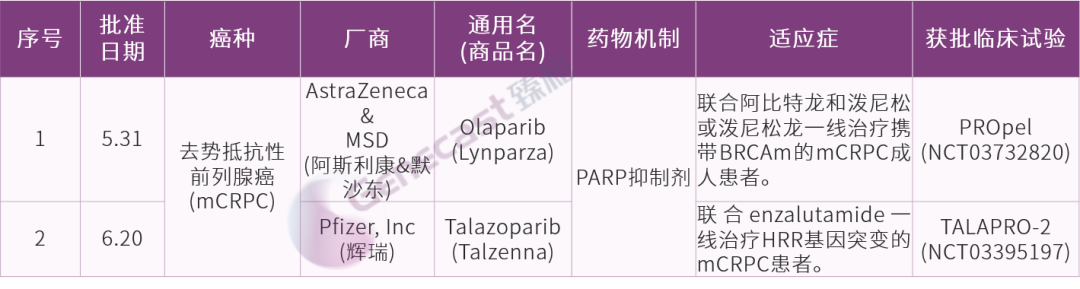
疗效数据显示,BRCAm突变患者的探索性亚组分析中,联合用药组的中位rPFS未达到,这些患者的OS HR为0.30。
Talazoparib是首个也是唯一一个联合恩扎卢胺一线治疗该疾病的PARP抑制剂。疗效数据显示,rPFS尚未达到。BRCA突变状态探索性分析的数据显示,携带BRCA突变的患者(n=155) 中Talazoparib联合恩扎卢胺组和恩扎卢胺组的中位rPFS分别为不可评估和11.0个月。
淋巴/血液

Zanubrutinib首次批准用于治疗CLL和SLL患者。SEQUOIA(NCT03336333)试验的疗效数据显示:zanubrutinib组中位PFS未达到,相比对照组呈现显著PFS优势(HR 0.42);ALPINE(NCT03734016)试验的疗效数据显示:zanubrutinib组ORR达到80%,mDoR未达到。Zanubrutinib是新一代BTK抑制剂,与以前的BTK抑制剂相比,具有更高的疗效和更好的安全性。
Pirtobrutinib是FDA批准的首个也是唯一一个可逆BTK抑制剂(不可逆的BTK抑制剂可能产生耐药性,因此不能持续性地用于治疗, Pirtobrutinib可以在BTK突变的情况下仍然保持活性,可以在现有BTK抑制剂治疗后的疾病进展情况下使用)。疗效数据显示,Pirtobrutinib组ORR为50%,mDoR为8.3个月。
疗效数据显示,与 R-CHOP 疗法相比, Polivy+R-CHP 将患者疾病进展、复发或死亡风险降低了27%,2年PFS率为76.7%,严重不良事件发生率为34%。
Epcoritamab-bysp是第一款获FDA批准治疗DLBCL患者的双特异性抗体。疗效数据显示, ORR为是 61%,CR为38%。在有反应的患者中,中位随访时间 9.8个月,估计的中位DoR为15.6个月。
Glofitamab-gxbm是首个,也是唯一一个治疗复发/难治性DLBCL患者的固定持续治疗的靶向CD20/CD3的双特异性抗体。疗效数据显示 Glofitamab-gxbm治疗组的CR为43.0%,OR(包括CR和PR)为56.0%,中位缓解持续时间为18.4个月。
*表格中标注“紫色”的为加速批准项(Accelerated Approval);标注“蓝色”的为加速批准项转为常规批准项(Regular Approval)。a:扩展适应症,b:新药获批。
注:
1-内容整理自网络可查的公开信息;
2-数据整理日期截止至2023-6-30。
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)