(一)PD-1注册研究中的伦理?
美国FDA认为:
根据21 CFR 312.120,未在 IND 下进行的临床研究应符合GCP,包括在研究启动之前由独立伦理委员会 (IEC) 审查和批准,以及在研究期间由 IEC 持续监督并应提供相关的文件记录。虽然申请人提供了 IEC的相关信息,但鉴于 ORIENT-11研究期间,默沙东K药已在中国获批上市,FDA尚不清楚IEC在解决知情同意问题方面发挥了什么作用。点评: 忍不住想说,这个问题FDA问得真是犀利啊!伦理委员会,是不是汗颜了?
来源于FDA
ORIENT-11研究未按照GCP更新知情同意书,以反映标准治疗方案的变化:中国已经批准默沙东K药非鳞非小细胞肺癌一线适应症上市。ORIENT-11 的知情同意书没有明确概述试验的替代方案,包括使用任何可用的批准疗法进行治疗或参与替代的临床试验;也没有及时进行修订。相反,知情同意书均依赖于研究者/研究医生讨论治疗选择。点评: 临床试验不能违背良心,违背伦理,FDA真棒!
ORIENT-11研究时间表
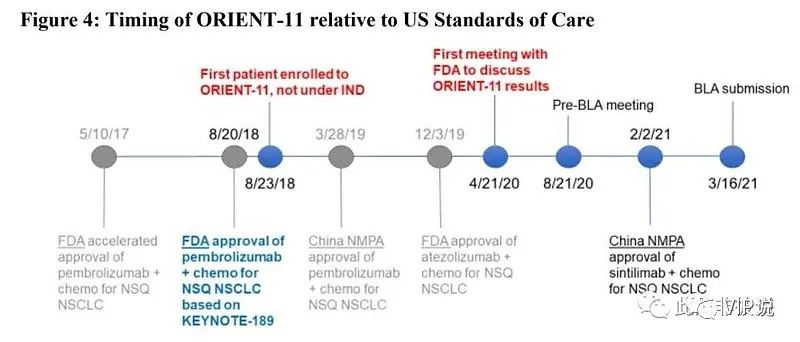
来源于FDA
①2018年8月20日,美国FDA批准,默沙东K药+化疗,一线治疗非鳞非小细胞肺癌适应症。②2018年8月23日,信达生物开展非鳞非小细胞肺癌一线3期临床试验。
FDA质问既然PD-1要在美国注册上市,为什么3天之后不修改临床试验方案?
③2019年3月28日,中国NMPA批准,默沙东K药+化疗,一线治疗非鳞非小细胞肺癌适应症。④2019年9月10日,信达伦理委员会应当更新《患者知情同意书》,允许疾病进展患者交叉治疗使用信迪利单抗/或者使用已经批准的帕博利珠单抗。因为OS数据来源于研究完成后。⑤2019年11月29日,中国NMPA批准,默沙东K药+化疗,一线治疗鳞状非小细胞肺癌适应症。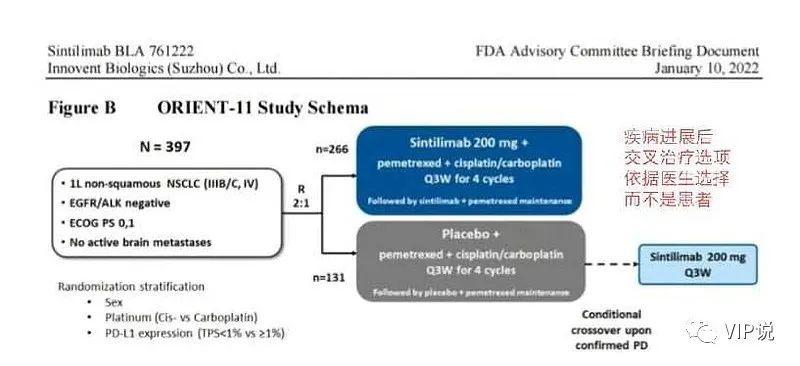
来源于FDA
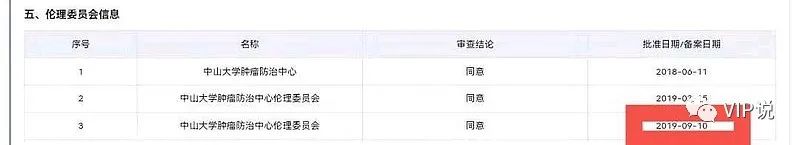 来源于CDE
来源于CDE
WHO将临床试验的行为视为,一种科学伦理和道德的规范。如果伦理有疑问,临床试验结果将不被FDA接受。
Choice01研究时间表
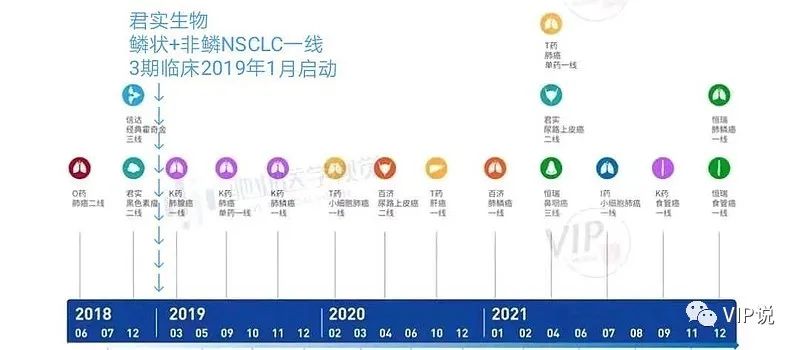
各家药企PD-1中国批准适应症时间表
①2018年8月20日,美国FDA批准,默沙东K药+化疗,一线治疗非鳞非小细胞肺癌适应症。
②2019年1月24日,君实开展非鳞+鳞状非小细胞肺癌一线3期临床试验。
③2019年3月28日,中国NMPA批准,K药+化疗,一线治疗非鳞非小细胞肺癌适应症。
④2019年11月29日,中国NMPA批准,K药+化疗,一线治疗鳞状非小细胞肺癌适应症。
⑤君实生物伦理委员,不需要更新《患者知情同意书》,临床试验设计方案已经明确——进展后交叉治疗方案。
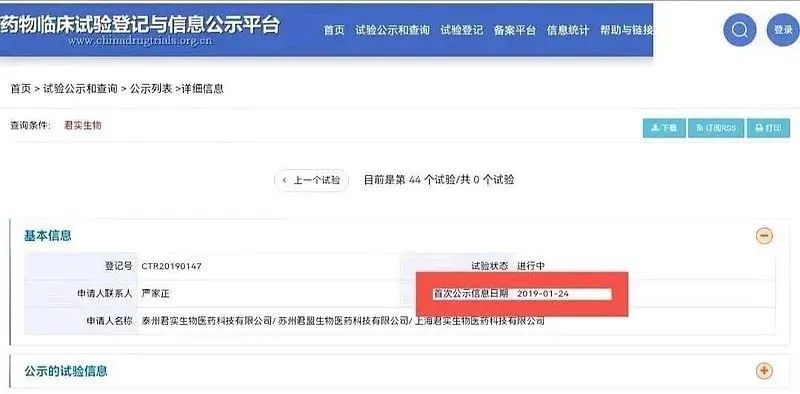
来源于CDE
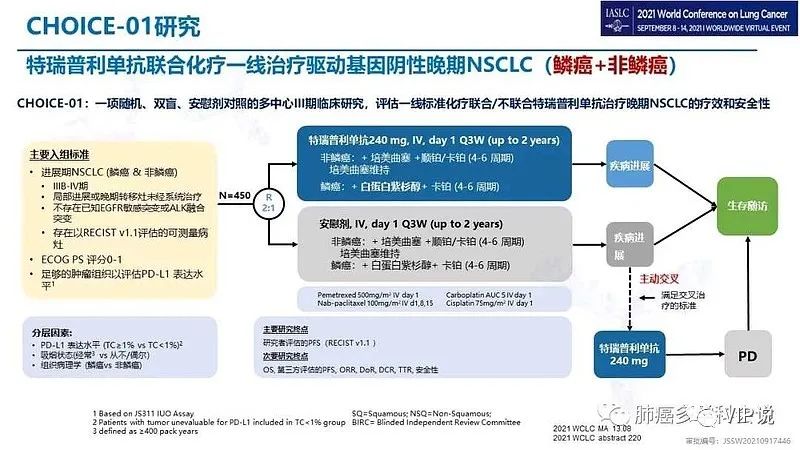
君实3期临床试验设计方案包括#化疗后主动交叉# 使用特瑞普利单抗。对比之下,信达的3期临床试验设计,太随意了,只包括了PFS阶段。信达生物的OS数据,不是事先设计的,完全是为了FDA事后补交的答卷。美国FDA认为:
PD-1非小细胞肺癌一线3期临床终点指标:ORIENT-11已经以PFS为主要研究终点,不适用于基于OS批准用于NSCLC的免疫检查点抑制剂先例的实践。迄今为止,所有 FDA 批准的转移性 NSCLC 一线免疫治疗方案均基于OS的统计学显著改善结果。(1)信达、恒瑞、百济、PD-1的非小细胞肺癌一线3期临床,都是PFS单一终点,全部被FDA否决。
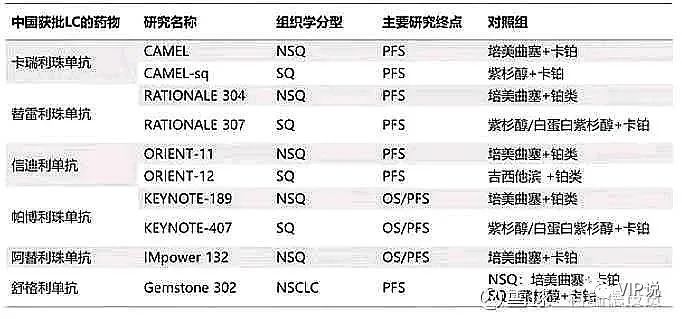
(2)君实 PD-1的非小细胞肺癌一线3期临床,用的PFS和OS双终点,FDA可能会接受——君实的美国桥接临床试验,费用低耗时短。
(3)信达对照组(安慰剂+化疗组)疾病进展后可有条件交叉至信迪利单抗单药治疗,OS数据是研究完成后。
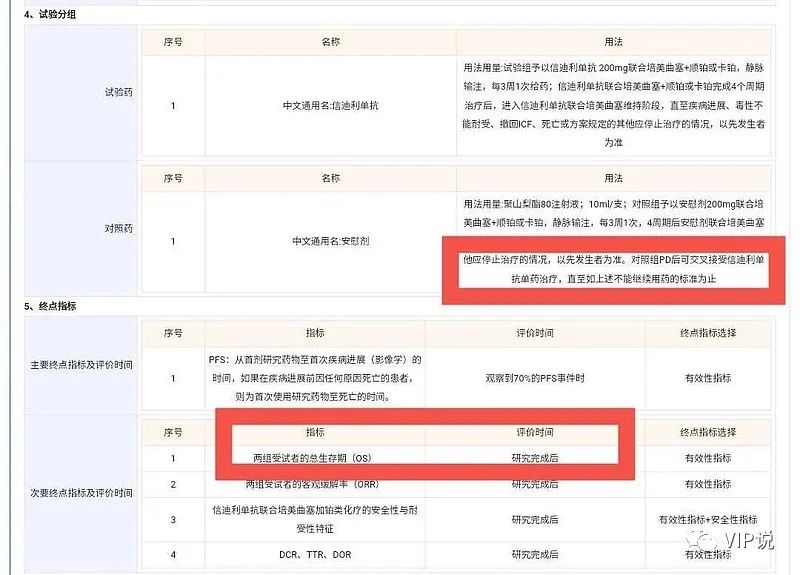
内容来源于CDE
信达PD-L1<1%亚组,信迪利单抗+化疗的PFS和OS没有显著疗效。
OS HR=0.754(0.477-1.194),OS没有统计学显著差异,
PFS HR=0.62(0.37-1.03),PFS没有统计学显著差异。
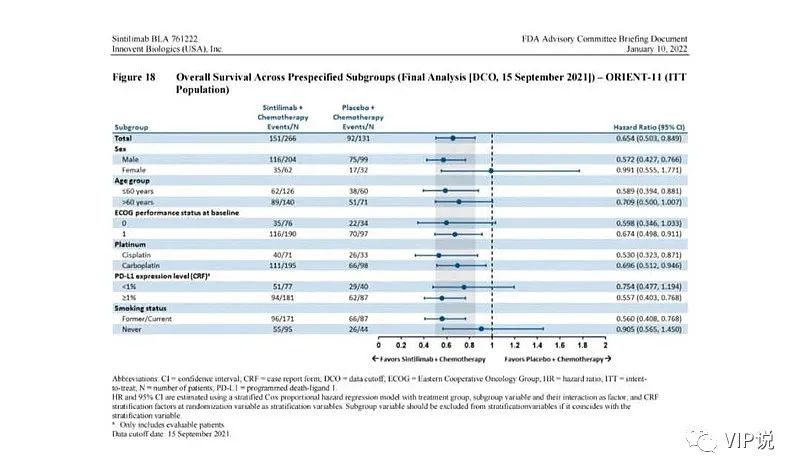 内容来源于FDA
内容来源于FDA
内容来源于FDA
(4)尽管百济的非鳞非小细胞肺癌一线是‘‘开放标签’’,不是双盲试验,OS HR=0.685,P值=0.0612,P值>0.05,但是OS没有达到统计学显著差异。
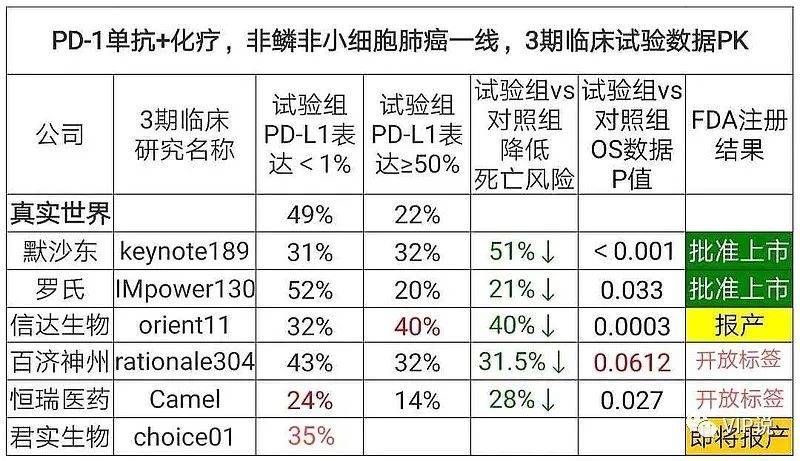
(5)君实尽管对照组(安慰剂+化疗组)患者在疾病进展时主动交叉接受特瑞普利单抗给药,但仍观察到OS显著疗效。

(三)总结
(1) Orient-11 研究伦理委员会(ICE),没有做出有利于患者的最佳选择,不符合患者的利益,临床试验终点是PFS,OS数据是事后补充,OS数据来源于研究完成后,FDA无法核查。
所以,FDA否决信迪利单抗上市,要求信达生物补做MRCTs(国际多中心3期临床试验)。(2) Choice-01 研究,事前设计了"疾病进展后交叉治疗"选项,最大程度符合了患者的利益.
并且2019年1月入组患者包括鳞状非小细胞肺癌,而中国2019年11月29日才批准了K药+化疗一线治疗鳞状非小细胞肺癌适应症,符合患者的最佳选择,保护患者利益最大化。
并且是PFS和OS双终点,没有片面追求所谓的临床试验进度(所谓的临床执行力),OS数据在研究期间,FDA可以核查。所以,FDA可能将要求特瑞普利单抗补做美国桥接临床试验,君实补充桥接临床试验费用低耗时短,将有最大上市优势。 版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)