2022-12-20

撰文︱毕亚光
责编︱方以一,王思珍
编辑︱杨彬薇
阿霉素(Doxorubicin,DOX)作为一线化疗药物抗肿瘤效果显著,但其严重的心脏毒性极大地限制了其临床应用[1]。阿霉素可引起心肌细胞发生多种方式的死亡,但目前临床上仍缺乏预防或治疗阿霉素心肌毒性的有效措施[2]。因此,探索阿霉素心肌毒性的机制并寻找有效的防御靶点,将为减少阿霉素及同类抗肿瘤药物导致的心肌毒性、提高肿瘤患者的生存率带来福音。
近日,复旦大学附属中山医院团队在Cell Death & Diseases杂志发表了题为“FUNDC1 protects against doxorubicin-induced cardiomyocyte PANoptosis through stabilizing mtDNA via interaction with TUFM”的研究论文。该研究报道了心肌细胞新型死亡方式——泛凋亡(PANoptosis)参与阿霉素心肌损伤过程,并揭示了线粒体膜蛋白FUNDC1对泛凋亡的调控机制,为阿霉素心肌病的防治提供了新的理论依据。

PANoptosis是一种新提出的程序性细胞死亡模式,可由细胞焦亡、凋亡和坏死性凋亡协同诱发,因而对细胞、组织和器官造成严重损害,但其是否参与心脏疾病及心脏损伤过程尚不明确[3-6]。研究人员通过检测扩张型心肌病患者心肌组织中泛凋亡相关分子的表达情况,发现泛凋亡水平升高,同时线粒体膜蛋白FUNDC1的表达呈显著下调趋势。在阿霉素诱导的心肌损伤小鼠模型及细胞模型中也发现同样的趋势,并且发现阿霉素心肌损伤模型中泛凋亡小体(PANoptosome)的激活主要由dsDNA感受器AIM2所介导。AIM2激活后与泛凋亡相关分子Pyrin、ZBP1、Caspase1、Caspase8、RIPK3以及 RIPK1形成泛凋亡复合体即泛凋亡小体,继而级联触发心肌细胞焦亡、凋亡和坏死性凋亡的同时激活,引起泛凋亡发生[7-8]。接着,通过在FUNDC1敲除的基因鼠中进一步验证发现,FUNDC1敲除使阿霉素诱导的小鼠生存率进一步降低,并且心脏结构、心肌细胞收缩功能以及线粒体结构、功能的损伤均进一步加重。而同时FUNDC1敲除促进泛凋亡相关分子进一步升高(图1),提示FUNDC1对心肌细胞泛凋亡具有一定调控作用。
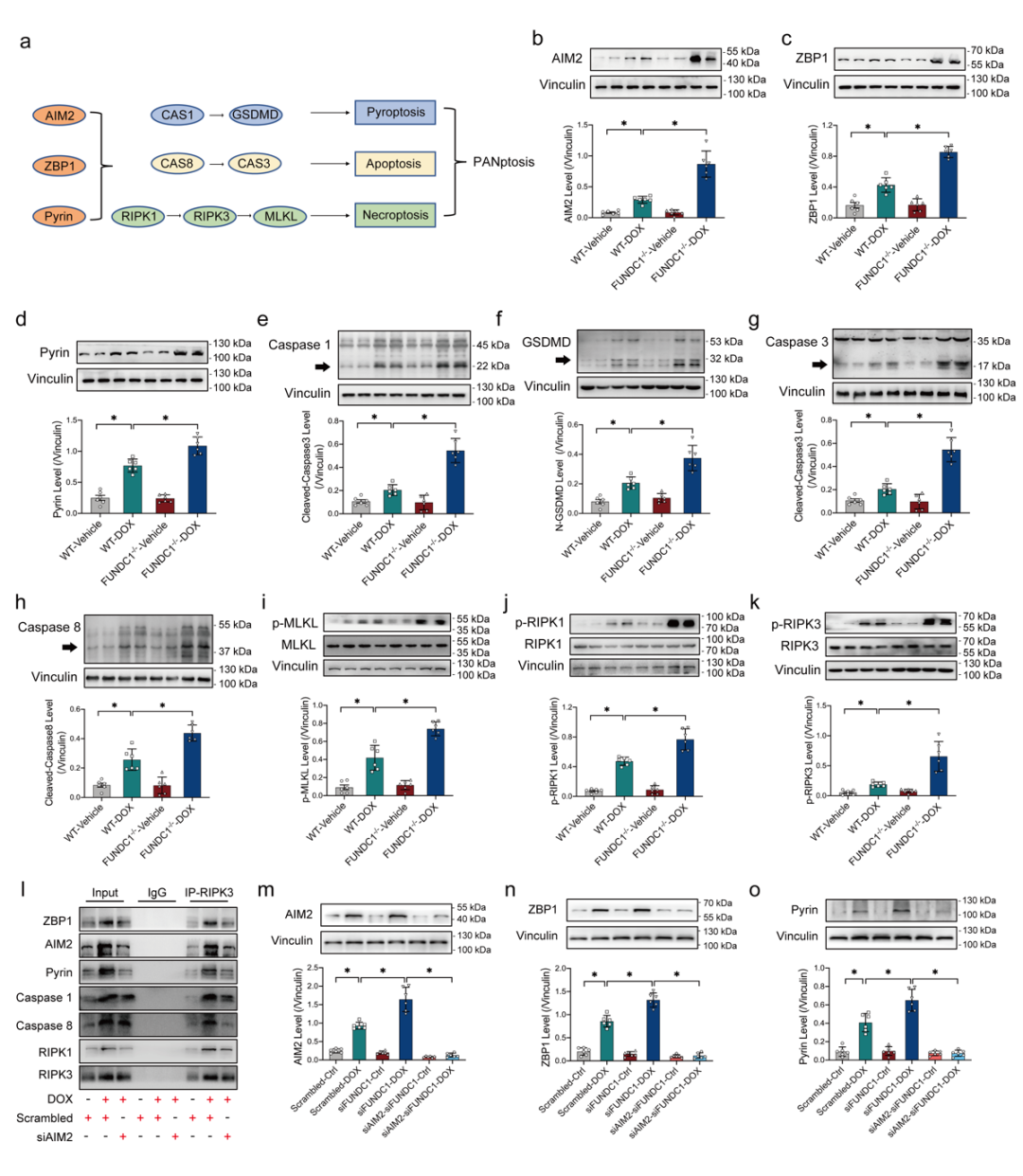
图1 FUNDC1敲除可进一步激活阿霉素诱导的心肌细胞泛凋亡
(图源:Bi, et al., Cell Death Dis, 2022)
然后,通过在细胞模型中分别将FUNDC1过表达或敲低发现,FUNDC1过表达可保护线粒体DNA(mitochondrial DNA,mtDNA)的胞质释放,并减少心肌细胞死亡,而FUNDC1的敲低却作用相反(图2)。mtDNA是泛凋亡相关分子AIM2激活的重要诱因[9]。因此,研究团队进一步使用mtDNA的祛除剂双脱氧胞苷三磷酸(2'3'-dideoxycytidine,ddC)证明其可以减少FUNDC1敲低对泛凋亡的进一步激活,提示mtDNA的胞质释放是阿霉素心肌损伤中诱导泛凋亡发生的重要机制,而FUNDC1可以通过减少mtDNA的胞质释放抑制心肌细胞泛凋亡的发生。
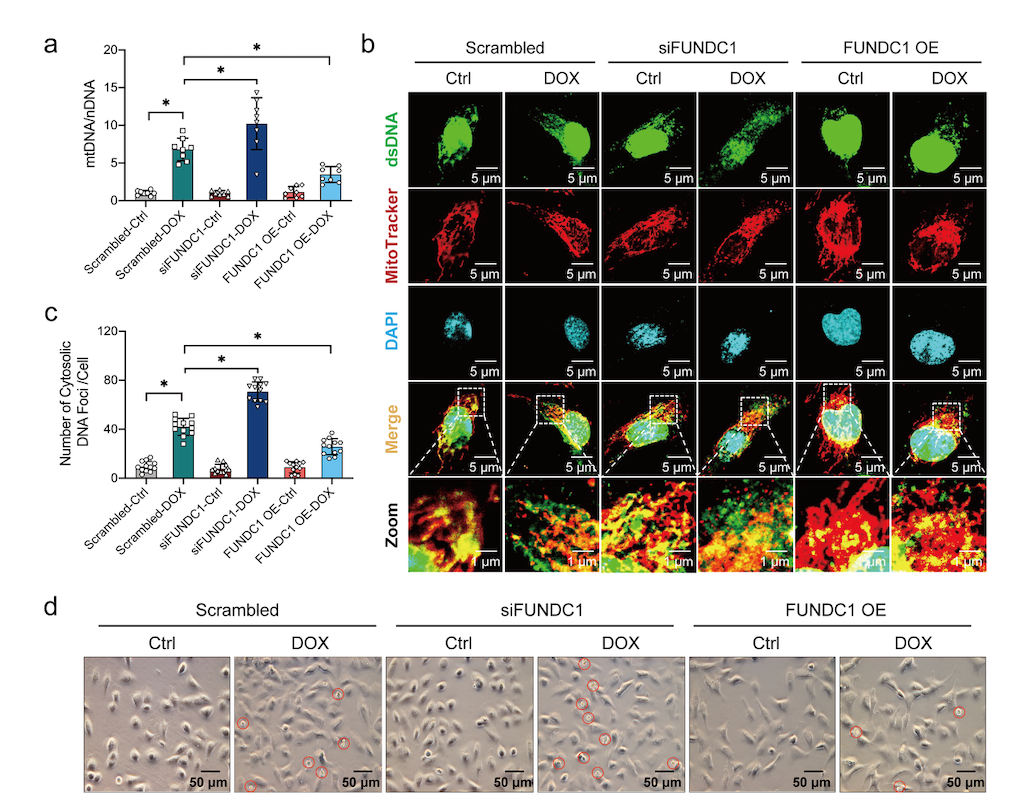
图2 FUNDC1可减少mtDNA的胞质释放及心肌细胞泛凋亡
(图源:Bi, et al., Cell Death Dis, 2022)
为了进一步寻找FUNDC1调控mtDNA的机制,研究人员进行了免疫共沉淀后质谱检测,筛选发现TUFM为排名第一的线粒体蛋白。TUFM为重要的mtDNA修复蛋白,可对线粒体中损伤的mtDNA进行修复,其在细胞质和线粒体均有分布[10-11]。通过构建结构域突变的质粒,进而通过免疫共沉淀、临位连接PLA技术及免疫荧光共定位进一步证实,FUNDC1可通过其95-133氨基酸位点的结构域与TUFM结合,该结构域为FUNDC1位于线粒体外的部分。这与研究者的猜想不同,FUNDC1并非同线粒体内的TUFM进行结合保护mtDNA。研究人员进一步通过提取细胞不同成分并进行Western blot分析发现FUNDC1结合TUFM并最终将细胞质中的TUFM招募至线粒体内。最后,通过敲低TUFM发现其可逆转阿霉素处理条件下FUNDC1过表达对mtDNA胞质释放以及对泛凋亡激活的抑制作用,表明FUNDC1可以通过结合并招募TUFM至线粒体,从而保护mtDNA,抑制mtDNA胞质释放,进而减少泛凋亡的发生。
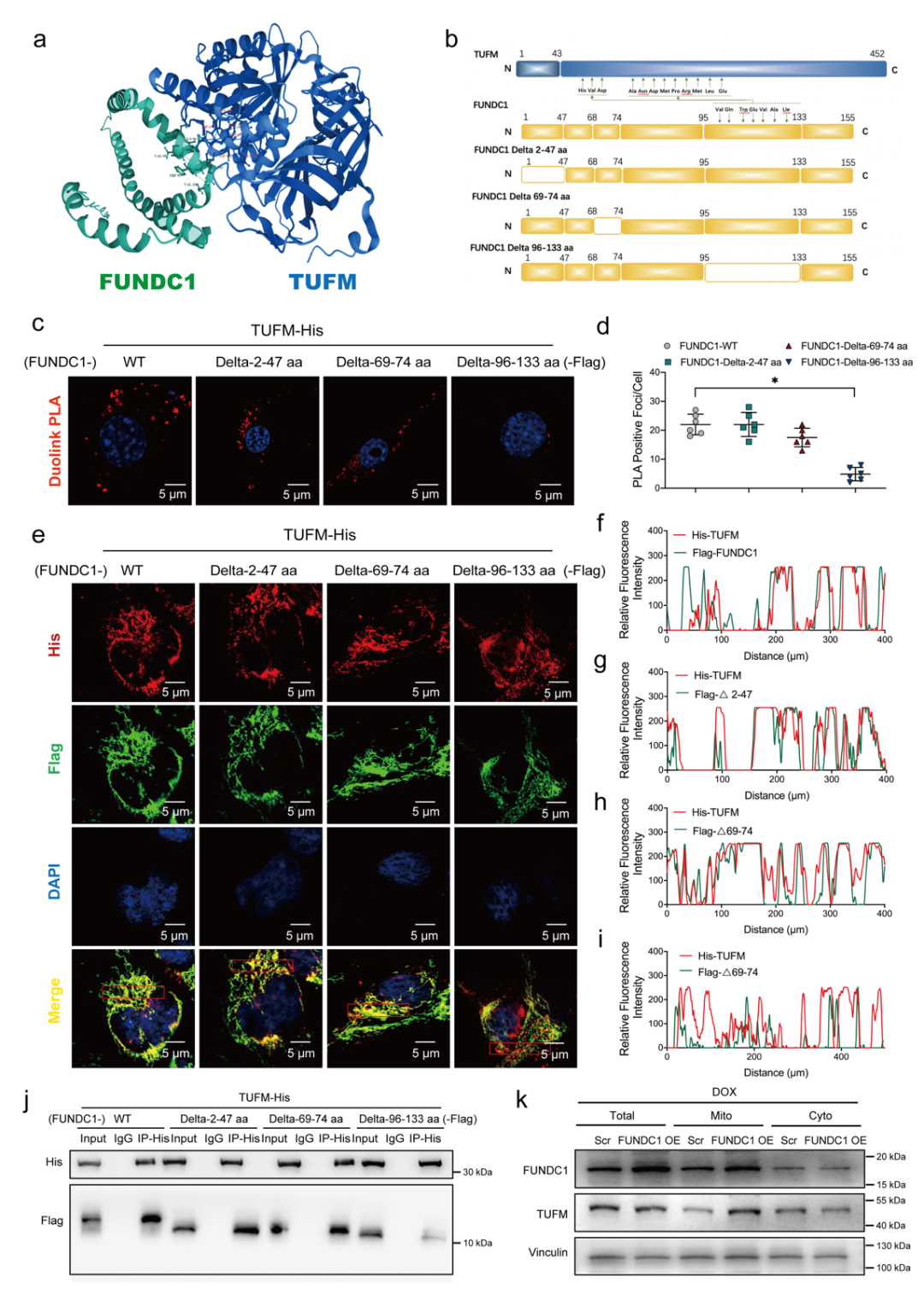
图3 FUNDC1可以结合并招募TUFM至线粒体
(图源:Bi, et al., Cell Death Dis, 2022)
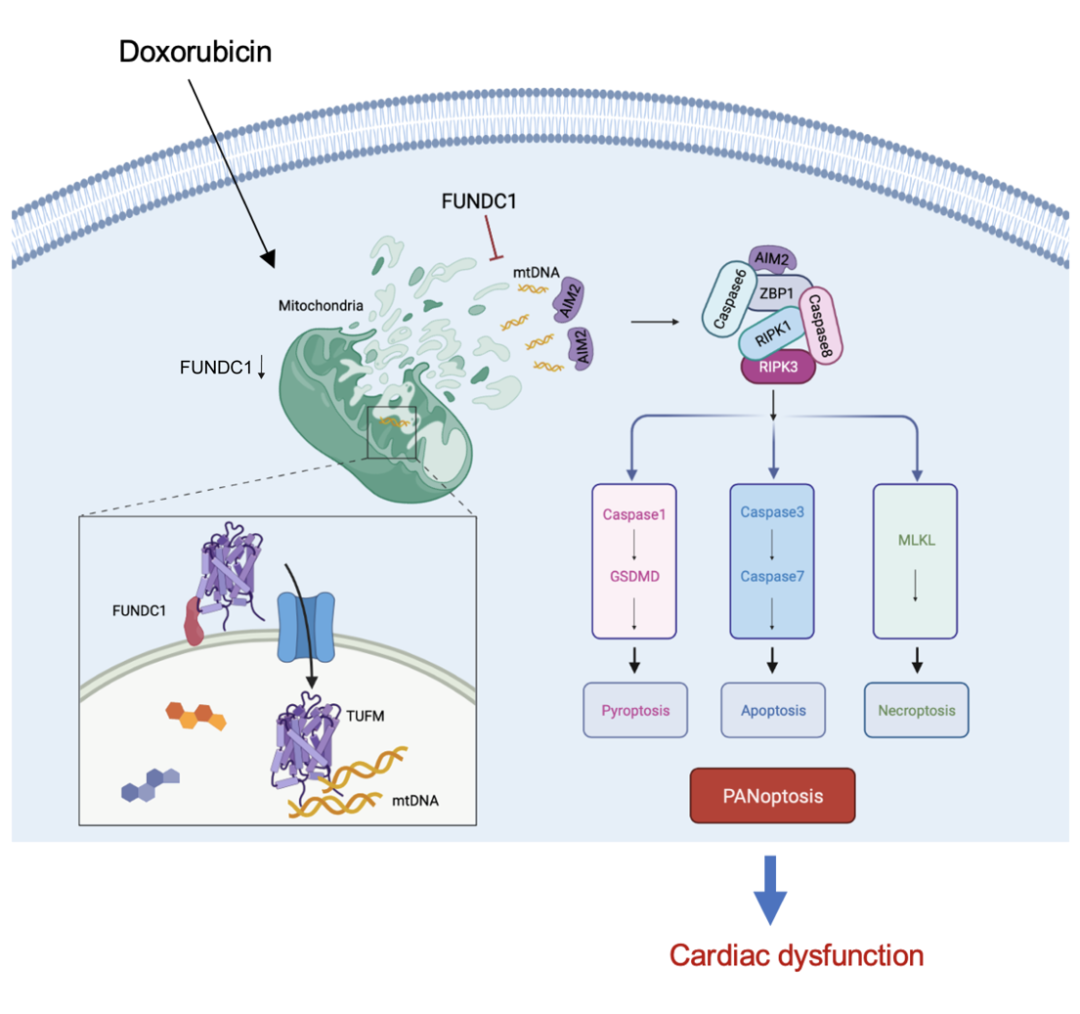
图4 FUNDC1保护阿霉素心肌损伤中mtDNA胞质释放及心肌细胞泛凋亡的机制图
(图源:Bi, et al., Cell Death Dis, 2022)
文章结论与讨论,启发与展望
综上所述,本研究揭示心肌细胞泛凋亡参与阿霉素心肌损伤过程,并证明FUNDC1可以通过调控心肌细胞泛凋亡来保护阿霉素心脏毒性和线粒体损伤。从机制上来说,FUNDC1可以通过直接结合和募集TUFM到线粒体内,从而抑制mtDNA释放到细胞质中,进而抑制阿霉素用药期间心肌细胞泛凋亡小体形成及泛凋亡的发生。然而,诱导肿瘤细胞泛凋亡也是化疗药物杀伤肿瘤的重要机制。因此,研究人员需要在未来的探索中进一步明确,FUNDC1通过抑制心肌细胞泛凋亡发生的同时,是否对阿霉素等抗癌药物引起的各种肿瘤细胞泛凋亡有影响,这将为其临床转化方式提供重要依据及提示。该研究为阿霉素心肌病的发生机制提供新的理论基础,并为阿霉素心肌病的防治提供一定的科学依据。
复旦大学附属中山医院毕亚光、徐海霞和汪翔博士为该文共同第一作者,葛均波、任骏和张英梅教授为该文的共同通讯作者。
参考文献
[1] Volkova M, Russell R. Anthracycline cardiotoxicity: prevalence, pathogenesis and treatment. Curr Cardiol Rev. 2011;7:214–20.
[2] Christidi E, Brunham LR. Regulated cell death pathways in doxorubicin-induced cardiotoxicity. Cell Death Dis. 2021;12:339.
[3] Zheng M, Kanneganti TD. The regulation of the ZBP1-NLRP3 inflammasome and its implications in pyroptosis, apoptosis, and necroptosis (PANoptosis). Immunol Rev. 2020;297:26–38.
[4] Malireddi RKS, Kesavardhana S, Kanneganti TD. ZBP1 and TAK1: master regulators of NLRP3 inflammasome/pyroptosis, apoptosis, and necroptosis (PAN-optosis). Front Cell Infect Microbiol. 2019;9:406.
[5] Samir P, Malireddi RKS, Kanneganti TD. The PANoptosome: a deadly protein complex driving pyroptosis, apoptosis, and necroptosis (PANoptosis). Front Cell Infect Microbiol. 2020;10:238.
[6] Zheng M, Karki R, Vogel P, Kanneganti TD. Caspase-6 is a key regulator of innate immunity, inflammasome activation, and host defense. Cell. 2020;181:674–87.e13.
[7] Lee S, Karki R, Wang Y, Nguyen LN, Kalathur RC, Kanneganti TD. AIM2 forms a complex with pyrin and ZBP1 to drive PANoptosis and host defence. Nature. 2021;597:415–9.
[8] Messaoud-Nacer Y, Culerier E, Rose S, Maillet I, Rouxel N, Briault S, et al. STING agonist diABZI induces PANoptosis and DNA mediated acute respiratory distress syndrome (ARDS). Cell Death Dis. 2022;13:269.
[9] Dang EV, McDonald JG, Russell DW, Cyster JG. Oxysterol restraint of cholesterol synthesis prevents AIM2 inflammasome activation. Cell. 2017;171:1057–71.e11.
[10] He K, Guo X, Liu Y, Li J, Hu Y, Wang D, et al. TUFM downregulation induces epithelial-mesenchymal transition and invasion in lung cancer cells via a mechanism involving AMPK-GSK3β signaling. Cell Mol Life Sci. 2016;73:2105–21.
[11] Liu J, Fang H, Chi Z, Wu Z, Wei D, Mo D, et al. XPD localizes in mitochondria and protects the mitochondrial genome from oxidative DNA damage. Nucleic Acids Res. 2015;43:5476–88
百度浏览 来源 : 岚翰生命科学
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。




发表评论
注册或登后即可发表评论
登录注册
全部评论(0)