2023-01-12

T细胞在阻止肿瘤细胞生长为癌症方面发挥了极其重要的作用。T细胞过继细胞治疗(ACT)不仅可以阻止肿瘤的发展,而且可以治愈肿瘤。近年来,肿瘤免疫治疗的各种ACT策略的发展促进了癌症治疗的实质性进展,本文集中在T细胞受体工程T细胞治疗(TCR-T),它正在成为一种有前途的癌症治疗方法。许多TCR-T临床试验正在进行中,用于治疗实体瘤。然而,在控制疾病和预防致命不良事件方面,优化治疗的安全性和有效性是重要的。提高TCR亲和力、增加TCR表达、减少错配、严格检测TCR特异性等改良TCR-T的新途径将为癌症患者提供更安全有效的免疫治疗。此外,TCR-T与其他治疗方法,如手术、放射治疗、化疗和免疫检查点阻断等相结合,可能会扩大TCR-T在治疗复杂恶性疾病方面的有效性。
前言
癌症已成为一个主要的公共卫生问题,也是世界上死亡的主要原因之一。现有数据显示,估计有1810万例新发癌症病例和960万例癌症死亡。肺癌是癌症死亡的主要原因(18.4%),其次是结直肠癌(9.2%),胃癌(8.2%),肝癌(8.2%),乳腺癌(6.6%)和食道癌(5.3%)。恶性肿瘤,特别是晚期疾病,消耗了大量的人力和财力资源,仍然很难治愈。
传统上,手术、化疗和放疗(RT)已经发展成为癌症治疗的三大支柱。但大伤口,耐药性和肿瘤复发证明了传统癌症治疗的缺点。另一方面,免疫疗法通过重组免疫系统内在功能来防止肿瘤形成或抑制其生长,在过去二十年中正在成为越来越可靠的癌症治疗方法,并形成新的支柱。但我们在免疫疗法中面临的最大挑战是,中枢和外周免疫耐受性的影响可以通过靶向肿瘤来阻碍免疫效应细胞。有许多策略可用于实施免疫疗法以克服免疫耐受性,例如治疗性疫苗,免疫检查点阻断,肿瘤微环境(TM)调节策略或过继细胞疗法(ACT)。
以青蒿素为基础的联合疗法在临床研究中显示出有希望的结果。迄今为止,各种以青蒿素为基础的联合疗法,如淋巴因子活化杀伤细胞(LAK)细胞、肿瘤浸润淋巴细胞、细胞因子诱导的杀伤细胞(CIK)细胞/细胞因子活化T细胞、γδ T细胞、自然杀伤(NK)细胞、嵌合抗原受体修饰的T细胞疗法(CAR-T)和T细胞受体工程T细胞疗法(TCR-T)已经在诊所进行了开发和测试。作为一种被动免疫疗法,ACT过程可能涉及从患者或健康人中分选免疫细胞,将细胞从体内扩增,然后将大量免疫细胞群注入患者以治疗癌症。依靠肿瘤特异性T细胞,一些ACT方法正在成为潜在的强大癌症治疗方法。
TCR-T治疗抗原的选择
在TCR-T基因治疗中,第一步是选择合适的肿瘤抗原进行TCR靶向。有三种主要类型的肿瘤抗原:(I)存在于健康组织中但在癌细胞中过度表达的肿瘤相关抗原(TAAs);(II)在癌细胞和睾丸、胎儿卵巢和滋养层中表达的癌睾丸抗原(CTAs)、(III)仅在癌细胞中表达的肿瘤特异性抗原(TSA),例如新抗原和致癌病毒产生的抗原。
为了确保TCR-T治疗的安全性和有效性,MHC在癌细胞上呈递的靶向抗原不应存在或在正常细胞上表达非常弱。对于特异性TCR分离和特异性靶向具有构建TCR-T的肿瘤,应对适当的T细胞表位进行批评。
TCR-T疗法具有识别大多数肿瘤抗原的优势,因为它们能够识别细胞外和细胞内抗原。在过去的几十年中,已经有许多表征良好的肽抗原被发表用于TCR-T的发展。在这些抗原肽中,NY-ESO-1[157-165]已被证明是安全有效的靶点之一,因此有超过30%的TCR-T临床试验针对NY-ESO-1[157-165]。HPV-16 E6和E7蛋白是TSA,与宫颈癌的发生密切相关,近年来靶向这两种抗原的TCR-T临床试验迅速增加。此外,许多TAAs,CTA或TSAs可用于TCR-T治疗,例如MART-1, WT1,HBsAg,AFP,MAGE(A3,A4,A6,A10),PRAME,CMV,EBV,gag,gp100,HA1,HERV-E,LMP2,CEA或P53(图1 A、B)。
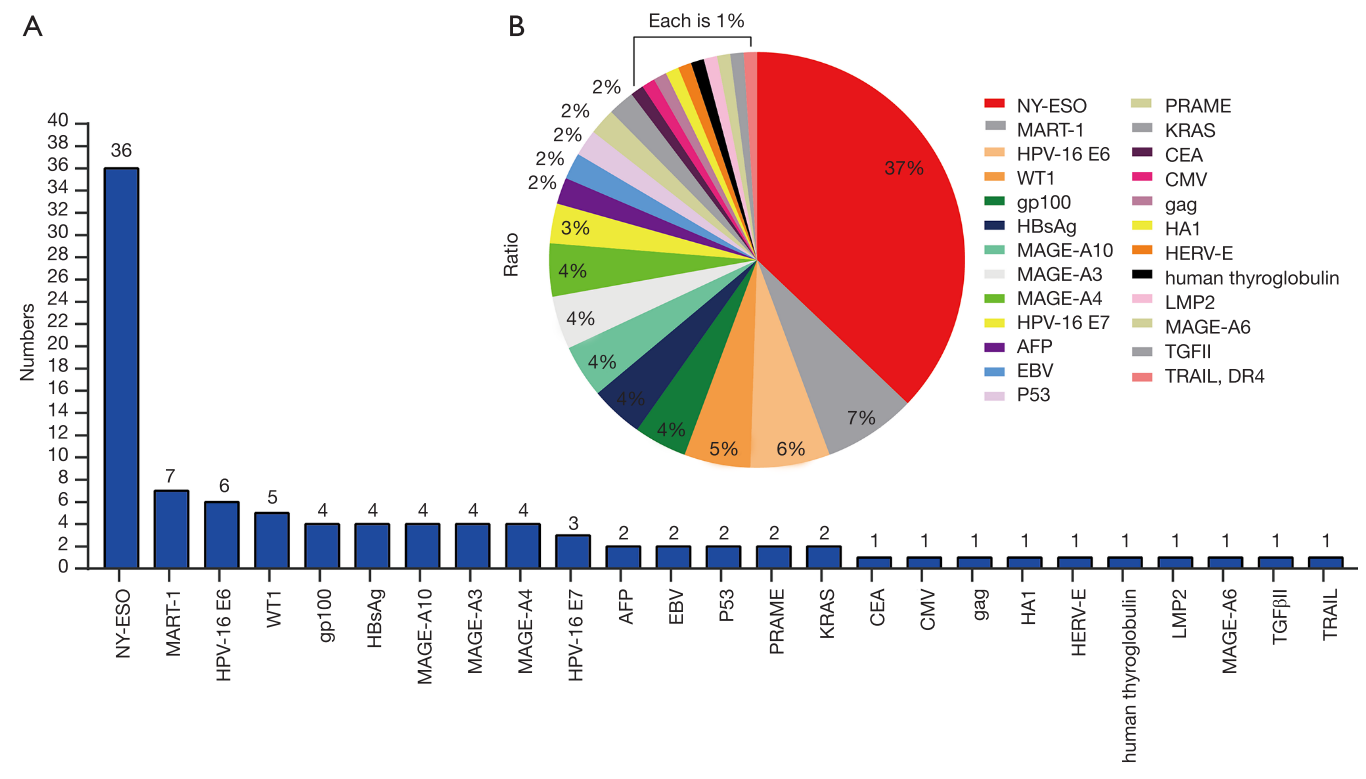
新抗原是潜在的良好癌症排斥抗原,由蛋白质体细胞突变产生,并且所得肽在正常人肽组中不存在。肿瘤特异性DNA改变和病毒开放阅读框都有助于TSA的池。靶向这些抗原的T细胞不受中枢T细胞耐受的影响,可有效控制肿瘤发生。
TCR-T的局限性和改进策略
TCR-T是一种TCR基因修饰的T细胞,具有一定的遗传性和被动局限性。TCR识别HLA限制性抗原,并且在T细胞成熟期间在胸腺处选择其结合亲和力,这是一个防止T细胞建立自身免疫的过程。然而,免疫系统的这种自我保护功能可以被肿瘤细胞放大和利用,以防止T细胞的攻击。此外,转基因T细胞可能导致脱靶毒性。另一方面,在TCR-T治疗期间,全身细胞因子释放,称为细胞因子释放综合征(CRS),可能诱发严重的不良事件,不受控制的CRS将破坏TCR-T的治疗。为了安全有效地治疗患者,研究人员和临床医生已经制定了一些策略来改善TCR-T的功能和安全性。
提高疗效
1)增强TCR亲和力
T细胞特异性靶向pHLA,其天然亲和力选择至~1-100μM,这限制了T细胞识别显示异常抗原呈递的肿瘤细胞。中枢和外周耐受性需要低TCR亲和力,因此由于胸腺选择或耐受诱导过程中的缺失,外周T细胞库中可能没有针对TAA的高亲和力CTL。在肿瘤微环境中,大多数肿瘤中MHC肽复合物(pMHC)分子的下调可能导致肿瘤诱导的免疫耐受性,因此TCR对pMHC的亲和力可能会限制其功能。因此,增加TCR和pHLA之间的亲和力可以克服肿瘤诱导的免疫耐受性并改善TCR-T功能。
使用TCR的酵母显示来筛选单链同种异体反应小鼠2C TCR的稳定突变体,并将其亲和力提高100倍。高亲和力2C TCR赋予转染T细胞更多的肽敏感性和CD8独立性。Boulter和他的团队展示了一种产生稳定TCR分子的策略,其中链间二硫键被引入TCR恒定域之间的界面中,这种方法被证明适用于各种TCR。
基于Boulter的研究,2005年使用噬菌体显示将TCR的亲和力大大增强至pM水平。证明这些高亲和力TCR对靶细胞表面pHLAs具有特异性和敏感性。高亲和力TCR重定向的CD8 T细胞比那些天然亲和力TCR重定向的CD8 T细胞释放更广泛的可溶性因子和更多的IL-2。HIV野生型和突变体都可以通过高亲和力TCR-T细胞有效控制。
2)增加TCR表达
如果TCR水平降低,反应阈值显着降低,T细胞群逐渐衰减。与小鼠恒定区域组装的人TCR可以表达更多的外源性TCR并介导更高水平的细胞因子分泌。此外,氨基酸在α链和β链的特定位点上突变为半胱氨酸以引入额外的二硫键,通过siRNA或锌指核酸酶(ZFN)抑制内源性TCR表达,将TCRα和β链基因片段与自剪接多肽2A连接起来,可以减少不匹配并增加外源性TCR的表达。
在这个免疫突触过程中,T细胞的活化由TCR和pMHC的组合触发,然后由CD3分子介导。TCR和CD3的共转染增强了TCR的表达,并导致更快的肿瘤清除。
3)细胞因子和共刺激信号
普通细胞因子受体γ链(γc),含有IL-2、IL-4、IL-7、IL-9、IL-15和IL-21,对T细胞的发育、增殖、分化和存活具有重要影响。提供外源性IL-2可增强T细胞在死亡阶段的增殖和存活。此外,IL-7在Socs3水平的下调和促进IL-6的产生方面具有作用,从而促进对慢性感染的免疫反应。IL-15和IL-21可以增强gp100 / HLA-A2定向TCR-T的细胞毒性,因为这些细胞因子具有增强颗粒酶A和B以及穿孔素1表达的能力。用IL-21预处理的WT1特异性T细胞可以发育记忆细胞并延长所有四名患者的寿命。IL-12条件下的酪氨酸酶特异性TCR-T表现出显着增强的功能活性,因为颗粒酶B表达升高,肽特异性CD107a脱颗粒升高。分泌IL-2 / IL-12并识别NY-ESO-1抗原的白细胞用于治疗转移性癌症(NCT01457131)。在T细胞培养过程中,细胞因子的结合对随后的体内治疗有显着影响。
共刺激信号,例如CD28 / B7提供的第二个刺激信号,对于T细胞活化也很重要。体外实验表明,EBV特异性TCR-T与CD28共表达可以显着增强抗原特异性IFN-γ产生。体内小鼠实验表明,TCR和CD3共转导的T细胞浸润肿瘤的速度更快,积累的数量更多,并且与仅由TCR重定向的T细胞相比,导致肿瘤清除速度更快。
提高安全性
1)插入自杀基因
CRS经常作为严重的副作用发生,并可能导致TCR-T治疗中的致命并发症。TCR-T可能导致靶向毒性,因为健康组织可能显示靶向抗原。预测错误配对的TCR组合的特异性并不容易,但非特异性可能导致脱靶毒性,从而对正常组织造成重大损害。自杀基因的插入是在严重CRS或毒性的情况下优化体内安全性和TCR-T细胞调节的替代策略。单纯疱疹病毒胸苷激酶(HSV-TK)是人类中经过大量测试的自杀基因,被证明是安全有效的,这使得TCR-T对更昔洛韦具有致命的敏感性。其他自杀基因,如截断的人表皮生长因子受体(tEGFR)、小分子二聚体、诱导性半胱天冬酶9安全开关(iCasp9)、寡肽、也经常用于提高安全性。
2)严格评估肽在正常组织中的潜在共表达
为了防止TCR-T免疫疗法中的靶向毒性,需要检查并确认靶向抗原是否可以在正常组织或器官中共表达。例如,在AFP特异性TCR-T疗法中,应用丙氨酸扫描(X扫描),不同种类的组织,细胞类型和HLA等位基因来测试特异性和安全性。
3)敲低内源性TCR
内源性TCRs的敲低可以减少错误配对并增加外源性重定向TCR表达,因为T细胞上外源性和内源性TCR链的共表达可能导致表面表达的竞争和不适当的匹配。核酸酶基因组编辑、RNA干扰(RNAi)、锌指核酸酶(ZFN)、转录激活剂样效应核酸酶(TALEN)和CRISPR / Cas9可用于敲低该基因。
工程新抗原反应性T细胞能否同时涵盖疗效和安全性?
TCR和抗原的库数很大,但我们只发现了一小部分用于开发TCR-T进行临床试验。同时,由于TSA(包括新抗原)在正常器官中不存在,因此专注于这些靶标的TCR-T疗法可能具有最佳的安全性特征。TAAs和CTA靶标的数量有限,因此靶向新抗原将有利于TCR-T免疫疗法的发展。癌症特异性突变可能通过下一代测序技术在个体患者中检测到。靶向KRAS等新抗原的TCR-T也已在临床试验(NCT03190941和NCT03745326)中进行了测试,并且在不久的将来将现实有效地治疗肿瘤患者。
总结
TCR-T是一种被动的癌症免疫疗法。为了准备TCR-T的治疗性注射,可以通过手动或机器在体外有效地生长大量T细胞,这可以使淋巴细胞免受体内免疫抑制环境的影响。各种宿主预处理方案也可以在TCR-T之前应用,以创造有利于输注T细胞生长的环境。这些重要的优势使TCR-T成为一种有前途的癌症免疫疗法。
TCR-T在治疗实体瘤方面比CAR-T具有优势,尽管该领域仍在研究中。这些令人鼓舞的实体瘤临床结果,如转移性黑色素瘤,证明了TCR-T治疗癌症的功能。如果靶向抗原(主要是TAA)不仅在肿瘤细胞上表达,而且在正常组织上表达,甚至在较低水平上表达,TCR-T可能会引起靶向毒性。因此,靶向在癌症上表达的抗原,如病毒特异性抗原和新抗原,已被证明是摆脱人迹罕至的减少附带损害的合理策略。
TCR-T有望成为癌症患者的一种非常有效的免疫疗法。另一方面,重要的是要进一步研究这些问题,例如如何预测和控制不良事件,如何寻找包括新抗原在内的新靶点,如何以低成本有效生产T细胞,以及如何将TCR-T与其他抗肿瘤疗法相结合。TCR-T过继免疫疗法将在不久的将来通过解决这些问题,特别是在实体瘤治疗中,有效安全地治疗患有许多恶性肿瘤的患者。
Liu, Q., Cai, W., Zhang, W., & Li, Y. (2020). Cancer immunotherapy using T-cell receptor engineered T cell. Annals of Blood, 5(2), 5–5.
Boulter JM, Glick M, Todorov PT, et al. Stable, soluble T-cell receptor molecules for crystallization and therapeutics. Protein Eng.
Morgan RA, Dudley ME, Wunderlich JR, et al. Cancer regression in patients after transfer of genetically engineered lymphocytes. Science.
百度浏览 来源 : TCRshows
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。




发表评论
注册或登后即可发表评论
登录注册
全部评论(0)