2023-01-16 来源 : 联川生物
目前有多项研究证明肠道微生物可以作为癌症发生和治疗应答的重要生物标志物和调节因子,同时很多证据表明肿瘤内存在微生物且肿瘤内的微生物群具有肿瘤异质性,肿瘤内微生物群可能直接调节肿瘤的发生、发展及其对化疗或免疫治疗应答的作用。2020年在Science上首次全面分析了肿瘤微生物组,结果表明在研究的肿瘤类型中都检测到了细菌DNA,且细菌DNA含量与肿瘤类型有关(Deborah Nejman et al.,2020)。Science:1526份7类肿瘤组织实证肿瘤细胞和免疫细胞中存在细菌 | 微生物专题。尽管肿瘤微生物已经受到多方面的关注,但其来源仍有多种说法。Walker等人总结了肿瘤中细菌定植的有利条件,包括血管紊乱、缺氧而营养丰富的微环境(Walker et al.,2020)。2022年Xie等人重点讨论了肿瘤微生物群的来源(图1):①肠道微生物打破粘膜屏障进入肿瘤组织部位,如胰腺癌内微生物通过胰管进入肿瘤部位;②肿瘤内微生物来源于肿瘤正常临近组织(NATs);③循环系统:肿瘤内微生物通过血液循环从口腔、肠道、肿瘤和其他部位进入肿瘤部位(Yifan Xie et al.,2022)。
人体的肺、胃肠道、皮肤等粘膜器官中存在着大量的微生物,在肺癌、结直肠癌、胰腺癌、宫颈癌和食管癌中都发现了肿瘤内微生物,肿瘤发生以及其他破坏人体粘膜屏障的行为可能为微生物提供入侵通道,使其成为能够发挥复杂作用的肿瘤内微生物群(Garrett et al.,2015)。但是,微生物打破粘膜屏障进入肿瘤组织部位并不能解释所有现象,如乳腺癌可能有其他来源的肿瘤内微生物。随之研究学者提取肿瘤内细菌可能来源于NATs,肿瘤组织中的细菌组成与NATs具有高度相似性(Nejman et al.,2020)。循环系统是肿瘤内微生物的另一个潜在来源。已有研究证明微生物通过血液传播定植的口腔菌群是肿瘤内菌群的重要来源(Shi et al.,2020)。【万字综述】Protein & Cell:微生物,肿瘤微环境中的不速之客 | 微生物专题

图1 肿瘤内菌群来源
肿瘤组织中存在细菌,并且不同的肿瘤类型存在的细菌种类也各有不同。那么这些细菌是如何定植到肿瘤组织中?定植下来的细菌又在肿瘤内发挥着怎样的作用?基于肿瘤组织的内在特征,肿瘤病灶可能是支持细菌入侵、存活和生长的理想环境,详情可见细菌为什么能定植在肿瘤中?| 微生物专题。肿瘤具有的缺氧、富含营养物质及其免疫特免的机制能够发挥影响宿主免疫应答、生物转化效力及细菌诱导治疗特性。基于肿瘤内微生物的多源特征及作用机制,将肿瘤内微生物群的组成与体内其他部位的微生物群进行比较,有助于识别不同肿瘤中存在的关键微生物,为癌症预防提供新的见解。
肿瘤微生物通过多种机制影响着肿瘤发生发展和治疗,已有研究报道细菌毒素对DNA的直接损伤作用、西式饮食下的细菌新陈代谢、感染炎症及移植抗肿瘤免疫反应都能促进肿瘤的形成和发展(Knippel et al.,2021)。更多内容可见最近发Cell的肿瘤微生物组,你都了解吗?| 微生物专题。除了不良习惯或感染引起,诱导肿瘤发生的两个主要机制:DNA损伤和激活致癌途径,这两种机制在探明肿瘤内微生物影响的抗肿瘤免疫及代谢化疗药物诱发的化疗耐药层面上具有重要意义。肿瘤微生物:瘤内微生物是如何促进胰腺癌发生?| 微生物专题
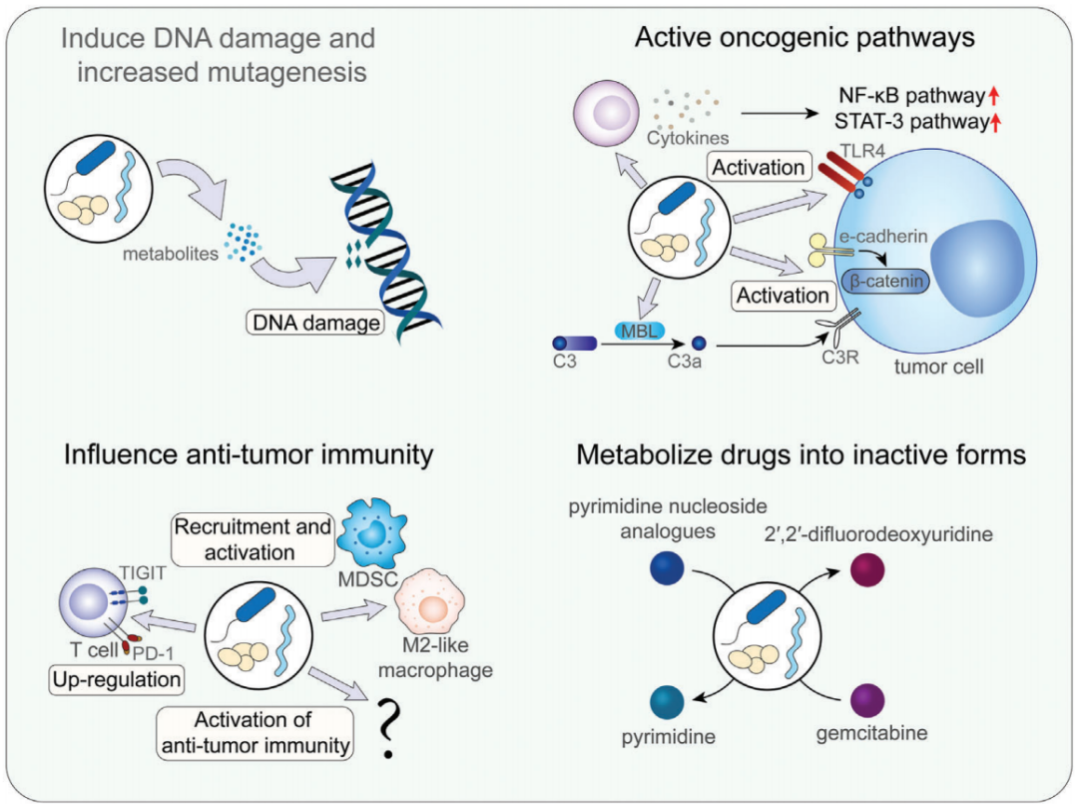
图2 肿瘤内微生物群影响肿瘤发生和治疗的机制
DNA损伤导致突变增加,最终可能导致肿瘤发生。多项研究表明,肠杆菌科的一些成员产生基因毒素,引起DNA损伤并诱导肿瘤发生(Janney et al.,2020);在几种类型的癌症中,尤其是胃肠道癌中,微生物群是导致DNA损伤的重要原因(Dziuba´nska-Kusibab et al.,2020)。致癌途径的激活也是肿瘤内微生物重要作用方式,多项研究表明,肿瘤内微生物可能影响细胞因子的产生(如IL-6和TNF-α),诱导促炎反应,进而激活NF-kB通路或STAT3通路,促进肿瘤进展(Garrett et al.,2015)。此外,一些toll样受体的成员,如TLR4和TLR5,与肿瘤和微生物之间的相互作用密切相关(Thomas et al.,2020)。Hoste等人报道,皮肤微生物群也可以通过TLR5信号通路介导促炎反应,从而影响皮肤癌的进展(Hoste et al.,2015)。肿瘤内微生物也会影响肿瘤的免疫微环境,从而影响肿瘤的发生和癌症的治疗。此外,肿瘤内微生物还可以通过将药物代谢为其非活性形式来直接影响化疗的效果,药物代谢效果主要依赖于肿瘤内微生物表达的酶,如γ-变形菌(Gammaproteobacteria)。在不同类型癌症中,肿瘤内微生物的组成和丰度也存在显著差异,肿瘤内微生物群的组成和功能可能因癌症的不同亚型而异。于君组Gastroenterology揭示CRC瘤内微生物异质性 | 肿瘤微生物。Yu等人的研究表明,栖热菌属(Thermus)在晚期肿瘤患者中增加,而军团菌(Legionella)在肿瘤转移患者中增加(Yu et al.,2016);在胃肠道肿瘤中拟杆菌门、厚壁菌门、变形菌门、梭杆菌门和放线菌门是胃肠道肿瘤中门水平上最丰富的类群;与正常组织相比,食管腺癌组织中拟杆菌门、厚壁菌门和梭杆菌门的丰度增加,变形菌门的丰度降低(Wang et al.,2021)。因此,基于不同肿瘤类型及其发生途径影响着肿瘤治疗的重要方式,个性化的治疗手段需要我们更多地了解肿瘤内微生物组成及代谢情况,这样十分有利于开发治疗癌症的特定策略。Nature:黑色素瘤内细菌来源的多肽或是免疫治疗新靶点 | 肿瘤微生物
2008年以来对于肿瘤微生物的研究通过多种方式进行,正如【收藏】2008-2020肿瘤组织微生物组研究纵览 | 微生物专题中文献介绍的有培养组学、免疫组化、荧光原位杂交等,但不同于高生物量的肠道菌群,由于肿瘤组织内的微生物生物量相对较低,并且肿瘤的宿主与细菌的DNA比率很高,与之对应的培养方法也未知,再加上容易受到外部污染,长期以来,表征肿瘤组织微生物群一直是一个挑战。随着下一代测序技术的发展和进步,特别是以检测微生物标记基因(如16S v3-v4 区域)为对象的扩增子测序的广泛使用,使得人体微生物群的鉴定驶上了快速道,包括许多基于培养法无法检测的微生物也被快速鉴定出来。常用的菌群多样性分析方案——16S v3-v4 已成功应用于肠道菌群、口腔菌群、阴道菌群等高微生物生物量样本的检测,然而这个方法用于肿瘤组织微生物鉴定,效果却一般,原因可能是宿主DNA占比过高对实验的干扰,16S v3-v4 的检测灵敏度不够高,更不用说核酸降解严重的石蜡包埋肿瘤组织样本(FFPE)。最近出现的优化升级版16S测序——5R 16S测序,即对 16S rRNA 基因上的五个区域(V2、V3、V5、V6、V8)进行多重 PCR 扩增和测序(图 3)。与V3V4区扩增策略相比,此方法扩增出的区域覆盖约68%的16S全长序列,可以大幅提高细菌物种检测的覆盖率和分辨率,尤其适合于低生物量的微生物样本检测(Nejman et al.,2020)。不仅如此,5R 16S测序还能兼容有一定程度降解的 FFPE 样本。万万没想到!FFPE样本居然还能做肿瘤微生物组!| 微生物专题

图3 5R 16S扩增16S rRNA基因的5个区域
灰色的R1-R5表示5R 16S扩增的5个区域
联川已将 5R 16S 测序技术用于数千份肿瘤组织样本(包括几百份 FFPE 样本)的瘤内细菌群的检测,包括头颈癌、肺癌、乳腺癌、胃癌、肝癌、结直肠癌、胰腺癌、前列腺肿瘤、宫颈癌等(部分为 FFPE 样本),还有非癌组织包括脑组织、鼻部息肉、消化道粘膜、胸腺导管、肺组织、肝组织、皮肤组织等,以及乳汁、血浆、血清、白细胞、子宫内膜拭子等,整体的检测效果令人满意。由此可以看出,5R 16S 测序不仅适用于肿瘤组织微生物的检测,也适用于其他微生物生物量较低样本的检测。联川用户刘瑶等通过对小鼠静脉注射 PBS、Lmo (单核细胞增生李斯特菌)或Lmo @RBC(改造后的单核细胞增生李斯特菌)来比较肿瘤免疫治疗效果,并借助5R 16S 测序对肿瘤组织内的菌群进行检测,结果发现李斯特菌仅出现在Lmo 和Lmo @RBC 组中,并且Lmo @RBC 的菌群多样性明显上升(图4)。进一步实验证实,Lmo @RBC 可诱导广泛的 Gasdmermin 依赖性细胞焦亡,从而逆转免疫抑制性肿瘤微环境并促进全身性的抗肿瘤免疫反应(Liu et al.,2022)。

图4 用5R 16S测序评估不同分组小鼠肿瘤组织中的菌群
尽管 5R 16S 测序具有非常高的检测灵敏度并且适用于降解样本中的微生物检测,然而从大量样本的检测数据中,我们也观察到有一些样本是难以检出菌的,这可能是样本自身的特性,比如菌含量极低,或是样本核酸降解非常严重,也有可能受限于实验技术本身等。为了顺利地开展肿瘤组织微生物检测,请重视项目中的研究细节,详情见做肿瘤微生物检测,这些实验设计你都知道吗?| 肿瘤微生物;做肿瘤微生物检测,这些问题需重视! | 肿瘤微生物。除了5R 16S,关于肿瘤微生物的研究我们还能通过什么方式去做?更多内容可见除了测序,还有哪些方法能证实肿瘤组织中存在微生物?| 肿瘤微生物

文章基本信息
标题:The human tumor microbiome is composed of tumor type–specific intracellular bacteria
发表杂志:Science
影响因子:47.728
实验分组:1526份肿瘤组织样本(冻存组织和FFPE样本)
研究方法:5R 16S rRNA 基因测序
研究设计:

图1 实验流程图
研究结果及亮点:
通过分析乳腺癌,肺癌,卵巢癌,胰腺癌,黑色素瘤,骨癌,脑瘤 7 种癌症类型 1526 个肿瘤及其邻近正常组织的微生物群,全面探查人类的肿瘤微生物组,并回答这些问题:肿瘤中是否存在微生物?肿瘤微生物群分布在哪及组成如何?肿瘤微生物群有什么功能?从脑部到骨骼的每种肿瘤都存在细菌,且不同类型肿瘤具有其独特的微生物组。其中,乳腺肿瘤中的细菌数量最多且种类最多。作者还发现瘤内细菌具有代谢活性,大部分位于细胞内,在癌细胞和免疫细胞中都存在。此外,瘤内细菌或其预测的功能,与肿瘤类型和亚型、患者吸烟状况和免疫治疗应答之间存在关联。本项工作是迄今为止肿瘤微生物组最全面的研究。

文章基本信息
标题:Tumor-resistant intracellular microbiota promotes metastatic colonization in breast cancer
发表杂志:CELL
影响因子:66.85
研究内容:乳腺肿瘤组织中是否存在微生物,微生物影响癌细胞转移途径和侵袭机制
研究方法:16S rRNA 基因测序、scRNA-seq
研究设计:

图1 实验流程图
研究结果及亮点:
肿瘤驻留的细胞内微生物群是一种新兴的肿瘤成分,作者主要使用小鼠自发乳腺肿瘤模型MMTV-PyMT来探讨这些肿瘤内细菌的功能意义。作者发现肿瘤内细菌的耗竭显著减少了肺转移,而不影响原发性肿瘤的生长。在转移定植过程中,肿瘤细胞携带的肿瘤内细菌通过重组肌动蛋白细胞骨架来增强对流体剪切应力的抵抗力,从而促进宿主细胞的存活。作者研究进一步表明,在两种转移潜能水平显著不同的小鼠肿瘤模型中,肿瘤内施用肿瘤内驻留微生物群分离的选定细菌菌株促进了转移。最终研究结果表明,肿瘤驻留微生物群,尽管生物量较低,但在促进癌症转移方面发挥着重要作用。因此,对肿瘤内微生物进行干预有助于推进肿瘤治疗。

文章基本信息
标题:Identification of bacteria-derived HLA-bound peptides in melanoma
发表杂志:Nature
影响因子:69.50
研究内容:入侵肿瘤细胞的细菌会将其蛋白片段呈递到肿瘤细胞表面,随后被免疫系统识别
研究方法:16S rRNA 基因测序、HLA肽组学
研究设计:

图1 实验流程图(Kalaora et al.,2021)
研究结果及亮点:
作者研究9 个人中 17 个黑色素转移瘤的细菌组分,发现来自同一人的不同转移瘤具有高度相似的细菌组分,表明在黑色素瘤中某些特定的细菌种类是相同的;基于免疫肽组学研究表明同一细菌肽既可以通过 APCs 呈递来启动免疫反应,也可以成为免疫系统攻击肿瘤细胞的靶点,肿瘤呈递的细菌多肽作为肿瘤特异性抗原将会是一种罕见而有用的治疗方式。
更多研究案例解析见Nature:Rob Knight团队发现血液和组织微生物组可诊断癌症|微生物专题、NC文章教你做高质量的肿瘤微生物组研究 | 肿瘤微生物、10分+文章带你揭开TP53-微生物-肺癌之间的关系 | 肿瘤微生物、【收藏】24类肿瘤的微生物组高分文献集锦(上) | 肿瘤微生物、【收藏】24类肿瘤的微生物组高分文献集锦(下) | 肿瘤微生物、肿瘤微生物+多组学轻松登上33分的JAMA Oncology,更多内容请关注联川生物公众号,回复“微生物”进行了解。
1. D. Nejman, I. Livyatan, G.The human tumor microbiome is composed of tumor type–specific intracellular bacteria[J]. Science, 368.
2. S. P. Walker, M. Tangney, M. J. Claesson, Front. Oncol. 2020, 10, 179.
3. Microbiota in tumors: from understanding to application. Xie Y, Xie F, Zhou X, et al., Zhang L*, Zhou F*. Advanced Science. 2022.
4. W. S. Garrett, Science 2015, 348, 80.
5. Y. Shi, W. Zheng, K. Yang, K. G. Harris, K. Ni, L. Xue, W. Lin, E. B.Chang, R. R. Weichselbaum, Y.-X. Fu, J. Exp. Med. 2020, 217.
6. Knippel RJ,et al. The Cancer Microbiome: Recent Highlights and Knowledge Gaps. Cancer Discov. 2021 Oct;11(10):2378-2395.
7. A. Janney, F. Powrie, E. H. Mann, Nature 2020, 585, 509.
8. P. J. Dziuba´nska-Kusibab, H. Berger, F. Battistini, B. A. M. Bouwman,A. Iftekhar, R. Katainen, T. Cajuso, N. Crosetto, M. Orozco, L. A.Aaltonen, T. F. Meyer, Nat. Med. 2020, 26, 1063.
9. R. M. Thomas, C. Jobin, Nat. Rev. Gastroenterol. Hepatol. 2020, 17,53.E. Hoste, E. N. Arwert, R. Lal, A. P. South, J. C. Salas-Alanis, D. F.Murrell, G. Donati, F. M. Watt, Nat. Commun. 2015, 6, 5932.
10. G. Yu, M. H. Gail, D. Consonni, M. Carugno, M. Humphrys, A. C.Pesatori, N. E. Caporaso, J. J. Goedert, J. Ravel, M. T. Landi, Genome.Biol. 2016, 17, 163.
11. J. Wang, Y. Wang, Z. Li, X. Gao, D. Huang, Front. Oncol. 2021, 11,6856.
12. Liu Y, et al. Intravenous Delivery of Living Listeria monocytogenes Elicits GasdmerminDependent Tumor Pyroptosis and Motivates AntiTumor Immune Response. ACS Nano. 2022 Mar 22;16(3):4102-4115.
13. The human tumor microbiome is composed of tumor type–specific intracellular bacteria[J]. Science, 368.
14. Lishay Parhi, Tamar Alon-Maimon, et al.Breast cancer colonization by Fusobacterium nucleatum accelerates tumor growth and metastatic progression.Nature Communications,2020,3259.
15. Fu A , Yao B , Dong T , et al. Tumor-resident intracellular microbiota promotes metastatic colonization in breast cancer. 2022.
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)