导语:2023年欧洲肿瘤内科学会(ESMO)年会将于10月20日-24日在西班牙马德里召开。大会吸引了全球顶级的肿瘤学者,众多肿瘤领域的中国专家也受邀参加,共同分享最新研究成果。本文整理了七大肿瘤热门领域集锦,以飨读者。
本次ESMO大会,主要分为ADC、新辅助免疫疗法和CDK 抑制剂三个部分介绍。
ADC:正在迅速改变无法手术或转移性乳腺癌的治疗格局
2023 年的 ESMO 大会上,一项III期大型随机试验TROPION-Breast01 报告了两种 ADC,Dato-DXd和曲妥珠单抗的良好结果。

这项实验的研究对象为 732 名既往接受过化疗的不能手术或转移性激素受体阳性、HER2 阴性乳腺癌患者。本次试验达到了主要终点,TROP2 导向的 ADC、Dato-DXd与研究者选择的化疗相比,无进展生存期 (PFS) 显着改善(6.9 个月 vs 4.9 个月;风险比 [HR] 0.63, 95) % 置信区间 [CI] 0.52–0.76;p<0.0001)。研究亚组的 PFS 获益是一致的。尽管数据尚未成熟,但总体生存(OS)率有利于 Dato-DXd组(HR 0.84,95% CI 0.62-1.14)。
TROPION-Breast01 试验:接受达托泊单抗德鲁替康治疗或研究者选择化疗的 HER2 阴性不可切除和/或转移性乳腺癌患者的无进展生存期
以往的研究表明,这些药物比传统化疗在HER2 阴性的转移性乳腺癌中更有效,这些积极的结果正在扩大 ADC 的治疗范围。正如所公布的DESTINY-Breast04试验的最新生存数据:

中位随访 32.0 个月后,接受曲妥珠单抗 deruxtecan 治疗的 373 名患者的中位 OS 为 22.9 个月,接受医生选择治疗的 184 名患者的中位 OS 为 16.8 个月(TPC;HR 0.69,95% CI 0.55-0.86)。曲妥珠单抗 deruxtecan 组的中位 PFS 为 8.8 个月,TPC 组为 4.2 个月(HR 0.36,95% CI 0.29-0.45)。在激素受体阴性肿瘤患者队列中,曲妥珠单抗德鲁替康与TPC相比,死亡风险降低了42%(HR 0.58,95%CI 0.31-1.08),疾病进展或死亡风险降低了71%(HR 0.29,95%CI 0.15-0.57)。
新辅助免疫疗法:
首次显示对HR 阳性早期乳腺癌具有显著益处
1、两项 III 期试验的数据显示将新辅助免疫疗法添加到激素受体(HR)阳性早期乳腺癌化疗中的益处
KEYNOTE-756 显示,与安慰剂加化疗相比,派姆单抗加化疗的病理完全缓解率显著增加(24.3% 对比 15.6%;治疗差异 8.5%,95% 置信区间 [ CI] 4.2–12.8;p=0.00005) 。pCR 获益在预先指定的亚组中基本一致,包括肿瘤 PD-L1 状态(CPS ≥1 与 <1)、淋巴结受累(阳性与阴性)和雌激素受体 (ER) 阳性(≥10% 与 <10%)。另一个主要终点——无事件生存期(EFS)——的结果仍不成熟。在新辅助治疗阶段,帕博利珠单抗组+ 化疗组 ≥3 级治疗相关不良事件 (TRAE) 发生率为 52.5%,而安慰剂组为 46.4%。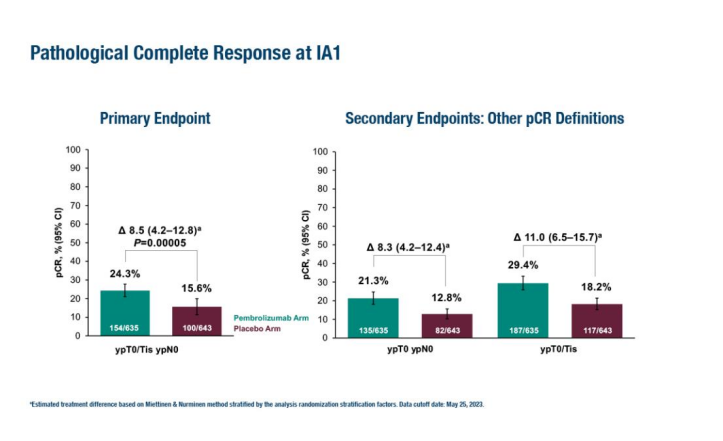
第二项试验 CheckMate 7FL 则报告了对 ER 阳性/HER2 阴性 2 级或 3 级乳腺癌患者的类似 pCR 益处。
该试验研究了新辅助纳武单抗+化疗与安慰剂+化疗,然后辅助纳武单抗或安慰剂+内分泌治疗。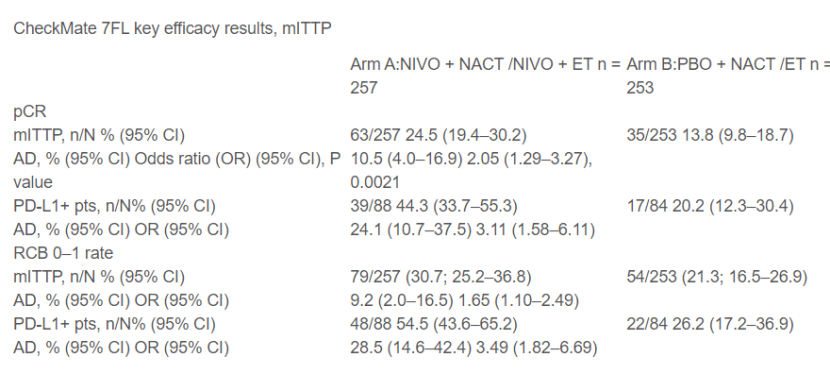
与对照组相比,新辅助纳武单抗联合化疗的 pCR 率显著提高(24.5% 对比 13.8%;比值比 [OR] 2.05;95% CI 1.29–3.27;p=0.0021),并且PD-L1+ 患者中纳武单抗的获益更大(44.3% 对比安慰剂的 20.2%;OR 3.11;95% CI 1.58–6.11)。
而由于KEYNOTE-522的阳性发现,帕博利珠单抗早已被批准用于新辅助治疗。
在今年的ESMO 大会上,KEYNOTE-522 提供了 III 期 KEYNOTE-522 研究的 EFS 更新结果。
中位随访 63.1 个月后,pembro组145例患者 (18.5%) 和 pbo 组108例患者 (27.7%) 发生 EFS 事件 (HR 0.63[95%CI,0.49-0.81])。无论 pCR 如何,新辅助帕博利珠单抗+化疗后辅助帕博利珠单抗与单独使用新辅助化疗相比,EFS 继续改善(81.3% vs 72.3%;风险比 [HR] 0.63,95% CI 0.49–0.81)。两组均未达到中位EFS。帕博利珠单抗的EFS益处在预先指定的亚组(包括PD-L1表达和淋巴结状态)中是一致的。此次更新提供了5年的随访数据,这是评估患者预后的关键里程碑。
不仅如此,NeoTRIP研究也显示了280名TNBC患者的PD-L1抑制剂阿替利珠单抗的阴性数据报告。
中位随访54个月后,新辅助阿替利珠单抗加化疗的EFS率为70.6%,而单独使用新辅助化疗的EFS率为74.9%(HR 1.076;95%CI 0.670–1.731)。
对于这些结果,可能的解释是阿替利珠的作用与帕博利珠和纳武利尤不同,因为它靶向肿瘤细胞上的PD-L1而不是T细胞上的PD-1,这可能有助于解释这些统计学上的阴性结果。
CDK 抑制剂:对 HR+/HER2-
早期乳腺癌具有持续疗效
今年《柳叶刀》发表的文章,III 期 MonarchE和 NATALEE分别对 abemaciclib(阿贝西利) 和 ribociclib (瑞博西利)进行研究

MonarchE

NATALEE 试验
研究数据支持使用细胞周期蛋白依赖性激酶 (CDK) 抑制剂作为激素受体 (HR) 阳性/HER2 阴性早期乳腺癌的治疗方法。
今年的ESMO大会也公布了更多关于这些试验的数据。
中位随访 54 个月后的五年疗效数据显示,在 monarchE 试验中接受阿贝西利联合内分泌治疗 (ET) 的患者与仅接受 ET 治疗的患者相比,疾病复发风险降低,侵袭性无病生存期 (IDFS) 的风险比为 0.680(95% 置信区间 [CI] 0.599–0.772),远处无复发生存期 (DRFS) 的风险比为 0.675(95% CI 0.588–0.774)。与仅ET组相比,阿贝西利组的死亡人数在数量上更少(分别为208例和234例),并且没有观察到新的安全信号。
今年的ESMO大会上,来自monarchE试验的进一步数据显示,无论Ki-67,雌激素受体(ER)和孕激素受体(PR)表达是否作为预后和预测生物标志物,阿贝西利在随访54个月时对IDFS的治疗效果是一致的。
ER+/PR-肿瘤患者的预后比ER+/PR+肿瘤患者差。接受阿贝西利布加ET治疗的患者36个月时的IDFS率在ER+/PR+肿瘤患者中为89.9%,ER+/PR-肿瘤患者为83.2%。对于仅接受ET治疗的患者,ER+/PR+肿瘤的IDFS率为85.9%,ER+/PR-肿瘤的IDFS率为72.8%。在ER+/PR+和ER+/PR-亚组中,阿贝西利均观察到显著的治疗获益。
在 MonarchE 试验中,无论 PR 表达如何,abemaciclib 对侵袭性无病生存的治疗效果均保持不变

然而,大会上提交的一项探索性分析结果显示,在接受 abemaciclib 治疗的 2,791 名患者中,分别有 832 名 (30%) 和 389 名 (14%) 需要减少一到两次剂量来控制不良事件。
在接受 abemaciclib 治疗的2791例患者中,832例 (30%) 降低了1次剂量,389例 (14%) 降低了2次剂量。年龄≥65岁或有≥4种既存合并症的患者更有可能降低剂量。在3个 RDI 组中 (≤66%vs 66%-93%vs≥93%),4年 IDFS 率基本一致(从最低 RDI 组到最高 RDI 组为87.1%vs 86.4%vs 83.7%)。根据时间依赖性模型,与剂量降低至 100 mg 或 50 mg 相比,保持完整 150 mg 剂量时 abemaciclib 的作用相似 (HR = 0.905;95%CI = 0.727,1.125)。
基于此得出结论,abemaciclib辅助治疗MonarchE 的疗效未受到剂量降低的影响。因此,应将降低剂量视为管理毒性和保留患者接受治疗的安全有效方法,以维持 abemaciclib 辅助治疗联合内分泌治疗的获益。
最后,在大会上提交的利博西利联合非甾体芳香酶抑制剂(NSAI)与单独使用NSAI的3年IDFS益处在所有临床相关亚组中是一致的
该分析共纳入5101例患者(数据截止日期:2023年01月11日;iDFS的中位随访时间,两组均为27.7个月)
这些发现与NATALEE试验的总体结果一致,并支持使用ribociclib作为HR阳性+ / HER2阴性早期乳腺癌患者的广泛人群的标准护理胃肠道肿瘤、结直肠癌
研究证实 ctDNA 在结直肠癌 MRD 评估
中的应用前景
在一项PEGASUS 试验:III期和高风险 II 期结肠癌患者的术后液体活检引导治疗的研究中,使用市售检测方法的ctDNA分析用于检查III期或高风险II期结肠癌患者手术后和辅助治疗后的微小残留病(MRD),表明液体活检可以通过减少不必要的毒性和改善对化疗的反应来帮助指导这些患者的术后管理。
在试验中,在术后阶段,LB + 患者接受了3个月的CAPOX,LB-患者接受了6个月的CAPE。主要终点是术后假阴性病例的数量,定义为连续两次 LB-疾病复发的患者(接受 < 14次复发)。中位随访时间为20,8个月,在35/135例患者 (26%) 中检测到术后ctDNA,其中12例 (34%) 复发,而100例 LB-患者中的9例 (9%) 复发,被定义为假阴性。ctDNA + 与复发风险明显增加相关(HR 4.37,对数秩P = 0.0003)。CAPOX 治疗3个月后,11/35例LB + 患者转为LB-(31%),但8/11例复发或 LB 再定位。在 CAPOX 后接受 FOLFIRI 的23例LB + 患者中,12例保持LB + (52%),其中6例复发,而11例在分析时转换为 LB-保持无复发 (48%),因此表明 LB 可用于通过减少不必要的毒性和改善对标准化疗的反应来指导 CC 患者的术后临床管理
PEGASUS 试验的结果表明 ctDNA 具有预后效应,26% 的 ctDNA 阳性 III 期或高风险 II 期结肠癌患者检测到 MRD
PEGASUS等研究不仅对于确定这种方法的分析有效性非常有用,而且对于确认其临床验证也非常有用。大会上的其他演讲也指出了ctDNA分析在实体瘤环境中的价值。
GALAXY对2,176名切除CRC患者的研究的更新证实,使用商业肿瘤知情测定(Signatera)分析的连续ctDNA状态是最重要的预后因素。它不仅可以预测患者结局,并且可能用于指导辅助化疗。
来自大会的一项III期ASCOLT试验的数据显示,在辅助化疗后1年内使用商业测定法(SafeSEQ)进行肿瘤初治的连续ctDNA检测与切除结直肠癌患者的复发有关。
新辅助免疫治疗在各种肿瘤类型中的表现振奋人心。根据 NICHE-3研究公布的数据,nivolumab + relatlimab(抗LAG3)新辅助治疗局部晚期 MR-缺陷结肠癌的首次给药和手术切除之间的中位时间为7.4周,治疗在19例患者中产生了79%的 pCR 率、89%的 MPR 率和100%的总体病理学缓解率。


所有 MMR 缺陷型结肠癌患者均通过新辅助纳武单抗加 relatlimab 获得了总体病理缓解
74% 的患者经历了 1-2 级免疫相关不良事件 (irAE),其中最常见的是输注相关反应 (32%)。只有 1 名患者出现 3 级 irAE(甲状腺功能亢进)。4 名患者患有内分泌疾病,需要补充;其中一名患者患有甲状腺功能减退症,另外三名患者患有垂体炎并继发性肾上腺功能不全。没有 4-5 级 irAE。
这项研究首次证明了 nivolumab/relatlimab 组合治疗 dMMR 结肠癌的有效性和安全性。II 期研究NITRO试验,发现围术期使用NALIRIFOX 对 107 名可切除 PDAC 患者的治疗是可控的且有效的。
107例患者入组并开始术前治疗(ITT人群)。疾病控制率为92.9%。87例 (81.2%) 患者行手术探查,11例 (10.3%) 术中有不能切除或转移病灶的证据,1例因手术并发症死亡。49例患者实现了 R0 切除,占65.3%,在很大程度上超过了55%的备择假设。更新后的中位随访时间为33.1个月 (IQR 23.1-43.6),ITT人群的中位总生存期 (OS) 为32.3个月 (95%CI 27.8-44.3)。切除患者的中位无病生存期和 OS 分别为19.3(95%CI 12.6-34.1) 和44.3个月 (95%CI 33.2-NA)。
TNF-α是化疗耐药途径TAK1/NF-κB的强效激活剂,是与反应和生存结果最显著相关的循环因子。结果显示,对于 rPDAC 患者,NALIRIFOX是可管理且有效的。
无独有偶,II期RAGNAR试验提供了精准医学在胰腺癌中的作用的积极数据。

结果显示显示厄达非替尼(一种FGFR抑制剂)在18例既往接受过治疗的晚期/转移性胰腺癌和预先指定的FGFR1-4改变(14 FGFR2,4 FGFR1)患者中具有临床意义的活性。总缓解率(ORR)为55.6%(95%CI 30.8–78.5),中位OS为19.7个月。安全性数据与厄达非替尼的已知特征一致。
结果显示,厄达非替尼在 FGFRalt 治疗的胰腺癌患者中表现出稳健且具有临床意义的活性。胃或胃食管交界处 (G/GEJ) 腺癌:
一线派姆单抗加 SOC将改变患者治疗前景
根据 III 期 KEYNOTE-811 试验的反应,派姆单抗加标准护理(SOC;曲妥珠单抗加化疗)最近在欧洲被批准用于治疗 HER2 阳性转移性胃或胃食管交界处 (G/GEJ) 腺癌
在大会上公布的III 期 KEYNOTE-811 研究的既往分析中,与安慰剂加 SOC 相比,一线派姆单抗加 SOC 显着改善了所有患者的 PFS(中位 PFS:10.0 个月与 8.1 个月;风险比 [HR] 0.72;95% 置信区间 [CI] 0.60–0.87;p=0.0002),且 PD-L1 综合阳性评分≥1 的患者(10.8 个月与 7.2 个月;HR 0.70) ; 95% CI 0.58–0.85),中位随访时间为 28.4 个月(摘要 1511O)。在 606 起 PFS 事件和中位随访 38.5 个月后的第三次中期分析中,24 个月 PFS 率分别为 24% 和 15%。
在第三次中期分析中,与安慰剂加 SOC 相比,派姆单抗加 SOC 的客观缓解率也有所提高(73% 与 60%),疾病控制率分别为 92% 与 87%,中位持续时间分别为 11.3 个月与 9.5 个月。
与安慰剂加 SOC 相比,在 SOC 中添加派姆单抗(曲妥珠单抗和化疗),中位随访时间为 28.4 个月,无进展生存期显着改善
在不可切除的HER2 + mG/GEJ腺癌患者中,与pbo + 曲妥珠单抗和化疗相比,一线pembro + 曲妥珠单抗和化疗提供了更优的 PFS 和改善的ORR,且缓解持久,尤其是PD-L1 CPS≥1的患者。这些疗效和安全性数据继续支持在一线治疗中使用该方案。这些数据将改变 HER2 阳性晚期 G/GEJ 癌症患者的治疗前景。
NSCLC 见证历史:
周彩存教授领衔两项国际多中心
Ⅲ期临床试验亮相ESMO
在今年的ESMO大会上,首次有中国学者在肿瘤领域以第一和通讯作者双重身份在NEJM发表两篇国际多中心临床研究结果,登上了全球医学最高舞台!

PAPILLON研究中,总计308名患者进行了随机分组(153名接受Amivantamab-化疗,155名接受单独化疗)。Amivantamab-化疗组的无进展生存期明显长于单独化疗组(中位生存期分别为11.4个月和6.7个月;疾病进展或死亡的风险比为0.40;95%置信区间[CI],0.30至0.53;P<0.001)。在18个月时,Amivantamab-化疗组的无进展生存率为31%,而化疗组仅为3%。
研究证明,amivantamab+化疗可显著延长携带EGFR外显子20插入突变的晚期非小细胞肺癌的中位无进展生存期(11.4个月 vs. 6.7个月;HR,0.40;95% CI,0.30~0.53;P<0.001);

PAPILLON研究中患者的PFS2

PAPILLON研究中患者的OS
在另一项纳入RET融合阳性非小细胞肺癌的3期LIBRETTO-431试验中,总计212名患者被纳入意向治疗-帕博利珠单抗人群的随机分组,在预定的中期疗效分析时,Selpercatinib组的中位无进展生存期为24.8个月(95%置信区间[CI],16.9至无法估计),而对照治疗组为11.2个月(95% CI,8.8至16.8)(无进展或死亡的风险比为0.46;95% CI,0.31至0.70;P<0.001)。Selpercatinib组的客观反应率为84%(95% CI,76至90),而对照治疗组为65%(95% CI,54至75)。影响中枢神经系统进展的特定原因的风险比为0.28(95% CI,0.12至0.68)。总体意向治疗人群(261名患者)的疗效结果与意向治疗-帕博利珠单抗人群相似。Selpercatinib和对照组治疗的不良事件与先前报道的结果一致。

与含铂方案化疗±帕博利珠单抗相比,selpercatinib可将中位无进展生存期延长1倍以上(24.8个月 vs. 11.2个月;HR,0.46;95% CI,0.31~0.70;P<0.001)。
PFS 几乎翻倍!
RET 抑制剂治疗 RET 融合阳性
晚期/转移性 NSCLC

一线 selpercatinib 与化疗和 pembrolizumab 在 RET 融合阳性 NSCLC 中的随机 III 期研究的结果报告了与晚期化疗 + 派姆单抗相比,Selpercatinib 在 PFS 方面取得了统计学上显著且具有临床意义的改善视网膜色素变性+ 非小细胞肺癌的成果。
LIBRETTO-431试验的结果强化了赛培替尼作为一线选择的使用,并可能扩大患者获得治疗的机会

LIBRETTO-431 试验中的无进展生存期
大多数接受第三代EGFR TKI奥希替尼治疗的EGFR突变(ex19del或L858R)晚期非小细胞肺癌(NSCLC)患者不可避免地会出现耐药性,复发后对新的一线治疗和选择的需求目前仍未得到满足。
基于此,ESMO 大会上的演讲揭示了 EGFR-MET 双特异性抗体阿米凡他单抗作为联合疗法在两项备受期待的 III 期试验中的阳性发现——MARIPOSA 用于初治患者和 MARIPOSA-2 在奥希替尼复发环境中– 证实了 CHRYSALIS 和 CHRYSALIS-2 研究的有希望的先前报告。

在MARIPOSA试验中,与接受奥希替尼单药治疗的429名患者相比,接受阿米凡他单抗联合脑渗透剂不可逆第三代EGFR TKI,lazertinib的患者的疾病进展或死亡风险降低了30%(风险比[HR] 0.70;95%可信区间[CI] 0.58–0.85;p<0.001),中位无进展生存期(PFS)为23.7个月(95%CI 19.1–27.7)和16.6个月(95%CI 14.8–18.5)。中位随访时间为22.0个月(LBA14)。阿米凡他单抗-拉替尼(86%)和奥希替尼(85%)的客观缓解率(ORR)相似,但阿米凡他单抗-拉替尼组确诊缓解者的中位缓解持续时间更长:25.8个月(95%CI 20.1-不可估计)与奥希替尼组16.8个月(95%CI 14.8-18.5)相比。在中期总生存期(OS)分析中,阿米凡他单抗-拉替尼优于奥希替尼的趋势(HR 0.80;95%CI 0.61–1.05;p=0.11)。
在MARIPOSA-2试验中,接受阿米凡他单抗化疗的患者PFS显著改善(n=131;人力资源 0.48;95% CI 0.36–0.64;p<0.001)和阿米凡他单抗-拉泽替尼-化疗(n=263;人力资源 0.44;95% CI 0.35–0.56;p<0.001)与单独化疗(n=263;中位PFS分别为6.3个月和8.3个月 vs 4.2个月)在中位随访8.7个月(LBA15)的比较。
MARIPOSA-2 试验中,阿米凡他单抗化疗和阿米凡他单抗-拉泽替尼化疗的中位 PFS 明显长于单独化疗
首次表明:免疫治疗和 ADC 联合治疗可替代一线化疗
含铂化疗是 la/mUC 的标准治疗 (SOC)。由于长期结果较差,仍存在未满足的需求。在 2023 年 ESMO 大会的总统研讨会上,介绍了两项针对既往未经治疗、局部晚期或不可切除的转移性尿路上皮癌患者的 III 期试验的改变实践的结果。

在 EV-302/KEYNOTE-A39 试验中,凝集素 4 定向抗体-药物偶联物 (ADC) enfortumab vedotin 与帕博利珠单抗的组合几乎使中位无进展生存期 (PFS) 和中位总生存期 OS翻了一倍。与化疗(顺铂或卡铂加吉西他滨)相比,在886例既往未经治疗的局部晚期或转移性尿路上皮癌患者中,中位随访时间为17.2个月。与化疗相比,Enfortumab vedotin 加 pembrolizumab 也显著提高了总缓解率(分别为 67.7% 和 44.4%;p<0.00001)。这项研究的结果已经期待已久,因为二十多年来,铂类化疗一直是标准护理,现在确定了在OS方面优于化疗的治疗方法组合。
几十年来,基于顺铂 (cis) 的化疗 (chemo) 一直是不能切除/转移性尿路上皮癌 (mUC) 顺铂合格患者 (pts) 的一线标准治疗 (SOC),既往尝试通过该治疗改善效果并不成功。CheckMate 901研究是第一个显示化疗加免疫疗法前期组合的有益影响的III期试验。
在化疗(吉西他滨-顺铂)中加入纳武利尤单抗可显著延长中位OS(21.7个月 vs 18.9个月;人力资源 0.78;95% 置信区间 0.63–0.96;p=0.0171)和中位PFS(7.9个月 vs 7.6个月;人力资源 0.72;95% CI 0.59–0.88;p=0.0012),在608例既往未经治疗、不可切除或转移性尿路上皮癌患者中,中位随访时间为33.6个月,与单独化疗相比。纳武利尤单抗加化疗的客观缓解率为57.6%,单独化疗的客观缓解率为43.1%,相应的完全缓解率为21.7%和11.8%。

与 GC 单药相比,NIVO + GC作为 mUC 的一线治疗在 OS 和 PFS 方面表现出具有统计学意义和临床意义的改善,且未出现新的毒性信号。NIVO + GC是首个在这种情况下改善 OS 的一线联合检查点抑制剂 + 化疗组合。这些结果支持 NIVO 加基于顺铂的化疗作为 mUC 患者的新SOC。
提出的两项研究对患者具有非常重要的意义,因为它们是首次挑战晚期/转移性尿路上皮癌患者一线铂类化疗的长期标准的试验。局部晚期宫颈癌(LACC)采用放化疗(CRT)治疗。然而,许多患者复发并死于转移性疾病。
一项随机 III 期GCIG INTERLACE试验结果显示,在放化疗(CRT)之前进行诱导化疗的5年无进展生存率(PFS)为73%,总生存率(OS)为80%,而放化疗(CRT)前的无进展生存率(PFS)为80%,而风险比[HR] 0.65;95%置信区间[CI] 0.46–0.91;p=0.013)和72%(HR 0.61;95%CI 0.40–0.91;p=0.04)。分别在局部晚期宫颈癌 中使用 CRT。该研究涉及500名IB1 / 2至IVA期患者,主要是鳞状细胞宫颈癌,中位年龄为46岁。总的来说,77%患有II期疾病,超过一半(58%)的淋巴结阴性。59%接受诱导化疗加CRT的患者和48%单独接受CRT的患者出现≥3级不良事件。中位随访时间为64个月。
隔行试验中的无进展生存期
诱导化疗组中的大多数(92%)患者接受了至少5个周期的卡铂加紫杉醇,诱导化疗和CRT之间的中位间隔为7天。作为 CRT 的一部分,每组中超过 80% 的患者接受了至少 4 个周期的顺铂治疗(诱导化疗加 CRT 组为 85%,CRT 组为 90%)。诱导化疗加CRT组分别有97%和98%的患者接受了外照射放疗和近距离放射治疗,在显管治疗组中分别接受了92%和97%的患者。每组CRT的中位总治疗时间为45天。III期试验结果显示PFS和OS发生率显著改善,提示放化疗前诱导化疗可改善局部晚期宫颈癌的预后,应被视为新的护理标准。INTERLACE 招募了来自不同医疗保健机构的患者,证明 IC 继 CRT 在所有国家都是可行的。
不光是放化疗前诱导化疗可改善预后。在KEYNOTE-A18试验中,帕博利珠单抗联合同步放化疗(CCRT)报告了令人鼓舞的结果,检查点抑制剂首次可以改善高风险局部晚期宫颈癌的预后。
显示接受帕博利珠单抗和CCRT的患者与安慰剂和CCRT相比,无进展生存期(PFS)有显著改善(HR 0.70;95%CI 0.55-0.89;p=0.0020)。
这是自1999年以来对局部晚期宫颈癌进行的第一个阳性研究,表明在局部晚期宫颈癌中使用检查点抑制剂是这种疾病的下一个前沿。检查点抑制剂在宫颈癌的治疗中起着关键作用,它们作为转移性,复发性或持续性宫颈癌的二线和一线治疗都是有效的。
除了鼓舞人心的阳性结果,也有许多疗法在本次ESMO大会上被证实无益处,这无疑是让人失望的,但是排除了所有的不可能,剩下的就是真相。失败的结果将为下一次的成功理清思路,让我们尽情期待未来新的突破!
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。






















































发表评论
注册或登后即可发表评论
登录注册
全部评论(0)