
免疫检查点抑制剂( ICIs )的出现已迅速改变了多个肿瘤的治疗模式,史无前例的改善了部分患者生存。尽管ICIs的响应具有持久性,但不幸的是大部分患者在经历最初响应后发生继发耐药。当前对于ICIs继发耐药的机制了解有限,这也可能阻碍下一代免疫疗法的有效开发。
近期纪念斯隆-凯特琳癌症中心Adam J. Schoenfeld和 Matthew D. Hellmann 教授在《Cancer Cell》上发表了一篇综述,总结了影响免疫疗效和继发耐药的挑战和最新临床报告,为克服免疫抑制剂继发耐药带来了一些新思路。



《Cancer Cell》是《Cell》旗下子刊,IF高达23.916
从2011年CTLA-4上市获批黑色素瘤适应症,近期十年PD1/PD-L1抑制剂已经获批超过20个适应症。
肺癌成为免疫治疗模式改变的典型:从最初I期研究6例患者仅有1例目标病灶有响应,到今天PD1/PD-L1抑制剂几乎成为所有确诊转移性肺癌治疗的重要部分。
治疗模式的改变很大程度上归功于ICIs所呈现的前所未有响应持续性。响应可以持续数年,即使终止治疗。
很大一部分患者无法从ICIs获益,PD1单药在某些肿瘤的整体响应率约为40-70%,然而在很多批准的响应率仅为10%-25%。部分初始对ICIs有响应的患者,后续也出现进展。
总之,仅很少一部分患者可以从ICI获取长期持续的卓越受益。更多患者经历了继发耐药。
ICSs耐药分为两大类:原发耐药、继发耐药。
克服原发耐药,主要通过联合治疗方案,验证预测biomarker。
继发耐药现在缺少规避或逆转的突破性治疗进展,仅有非常有限的继发耐药的特点或机制的研究发表。
缺少继发耐药发生率的常规报告,不同肿瘤的发生特征也不清楚。本研究通过已有的不同肿瘤的响应持续性数据去推测继发耐药发生率特点:- 不同肿瘤整体上看,总响应率和获得耐药率呈反比关系。

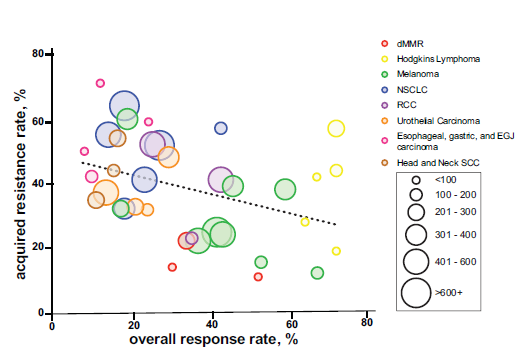
Figure 1. Rate of Acquired Resistance and Overall Response by Tumor Type
Different tumor types are represented by colored circle and number of patients is represented by size of the circle.
免疫继发耐药机制的数据有限,如靶向耐药对比会有启发性。
免疫治疗继发耐药机制有以下三个挑战:


深刻理解这些挑战对于解读之前的报道和开展临床研究非常重要,这或许帮助未来全面成功的揭示继发免疫耐药机制。
为了分析和解读众多研究结果,对继发耐药应当建立一个清晰和一致的框架,免疫继发耐药缺少标准的定义。将靶向耐药标准用于PD1/PD-L1耐药需要更细致入微的考虑。癌症免疫治疗学会( The Society for Immunotherapy of Cancer )已经成了一个anti-PD-(L)1工作小组并召开了anti-PD-(L)1耐药研讨会,更深度的讨论即将来临。本研究也建议为了达成该共识的目标,两个重要特征需要特别强调考虑:
初始响应度(Depth of Initial Response)
药物暴露量(Drug Exposure)

第一,与靶向治疗不同的,ICIs的响应不太普遍,而且继发耐药的发生更加特异。EFGR突变肺癌,约80%患者最初奥希替尼治疗有效,但几乎所有的响应者最终发展为耐药。靶向治疗前后收集组织标本可以非常有效的预测响应和继发耐药。
ICIs仅非常少比例的患者最初对治疗有响应,而且响应患者出现继发耐药的情况也很多变。收集所有患者基线标本去预测响应和继发耐药效率不高。ICIs继发耐药的不可预测性使得设计和执行成功的相关性研究非常困难。第二,寡进展模式可能是ICIs继发耐药的常见模式,这一模式使得比较位点匹配组织样本这一理想的想法更加复杂。第三,免疫治疗进展时肿瘤穿刺活检也存在问题,因为这存在临床可操作性不确定。因此,通过协同努力去识别继发耐药患者非常重要,研究中心和公司研发部门合作对解决小样本问题是一个潜在的方案,可以帮助克服治疗前样本或治疗后样本缺少这一挑战。
已经发表的几个报道,使用常规分子学工具去监测ICIs继发耐药的肿瘤和微环境均没有明显的发现。DNA和RNA的高通量NGS对于靶向继发耐药很有帮助,但对于ICIs继发耐药仅揭示了非常有限的几个继发基因改变(主要是抗原呈递和IFN-r信号通路)。ICIs继发耐药可能更微妙,动态和复杂,至少三个方面相互作用(宿主,肿瘤,肿瘤微环境),两个组成(肿瘤内和全身系统)。因此必须从肿瘤和免疫细胞的基因,功能和部位开展多方位和高分辨率研究。
新抗原进化和呈递,固有和适应性免疫响应,表观基因修饰,肿瘤异质性等众多因素可能和免疫抑制剂有效性相关,但传统测序方法不能有效解决。另外,单细胞影像和测序方法可能也需要去评估ICIs响应的肿瘤细胞和肿瘤免疫微环境的克隆进化。基于以上三点,研究对已发表的ICIs继发耐药的临床报道和临床前研究开展了一个回顾性分析。
现有关于ICIs继发耐药的报道非常少,总共检索出13个临床报道,58个ICIs继发耐药患者,覆盖所有肿瘤。
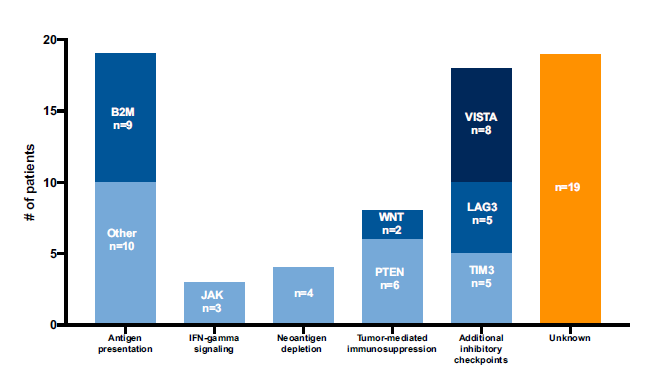
Figure 2. Summary of Reported Mechanisms of Acquired Resistance to Immune Checkpoint Inhibitors
The number of clinical cases by reported mechanism of acquired resistance mechanism are shown. Some cases report multiple acquired resistance mechanisms.
这些报道采用了不同的继发耐药的定义,代表了不同的异质性人群。一些报道仅有初始PR或CR患者,另外一些研究包括了SD或“混合反应”( ‘‘mixed responses’’)。虽然很多病例没有确定或未知的机制,但这些特殊耐药机制概况起来大概分为以下几类: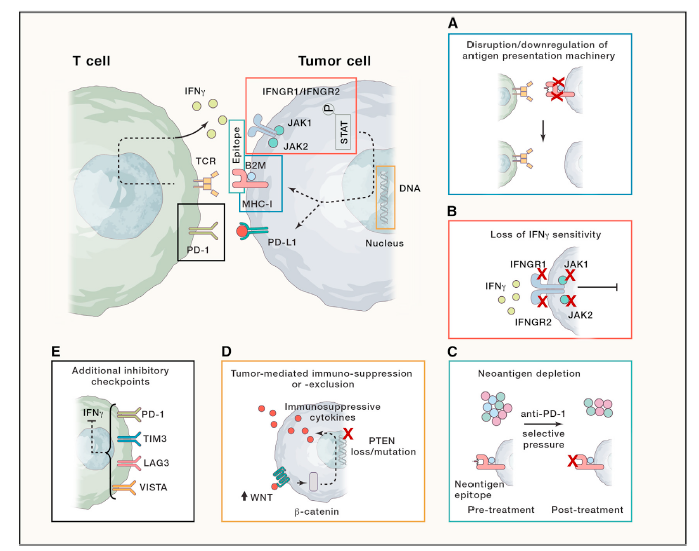
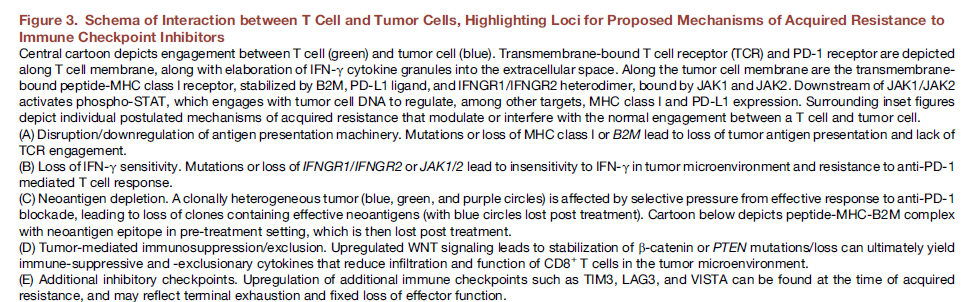
T细胞调节免疫活化依赖于抗原呈递细胞MHCs对抗原的识别,I型MHC的肿瘤抗原呈递通过多个基因表达进行调节。例如:一个重要的基因 β2微球蛋白 (B2M),B2M改变是ICIs继发耐药机制一个新的发现。
效应T细胞释放的IFN-γ通过JAK-STAT通路激发肿瘤细胞下游信号传递,调节I型MHC和PD-L1表达,通过多个途径诱导肿瘤细胞死亡。其中该信号传递中关键的早期一个步骤是IFN-γ结合异二聚体IFNGR1/INFGR2激活JAK1和JAK2。最近临床报道揭示,JAK1或JAK2失活和ICIs治疗进展相关。另有报道,JAK1, JAK2和IFGNGR 改变和免疫原发耐药有关。关于这些突变的临床报道有限, 除了JAK1 and JAK2 之外IFN-γ通路其它基因改变和ICIs继发突变关系仍然不清。
新抗原特异性T细胞可能是ICIs响应的关键驱动。因此,编码特定肿瘤特异新抗原的体细胞通过克隆选择,表观遗传修饰抑制或拷贝数丢失等发生突变,导致后续免疫逃逸和肿瘤进展。
临床前试验模型中,肿瘤抑制因子PTEN的丢失,可增加免疫抑制因子表达和减少T细胞效应因子IFN-γ,导致T细胞调节的浸润和免疫。与PTEN类似,黑色素瘤中WNT-β-catenin活性和免疫抑制因子产生,树突细胞启动改变,调节T细胞促进和显著T细胞浸润缺少相关,WNT-β-catenin在ICI耐药也可能起作用。
有报道,出现继发耐药时会有其它T细胞检查点蛋白表达,包括TIM3,LAG3,VISTA,但这些改变和耐药是否有因果关系还不清楚。
虽然该研究对很多报道进行了讨论,但研究者特别提示,验证和识别一个特异性继发耐药的充满挑战。这些报道中,有些没有机制探讨,另外一些是重叠机制或从间接数据中推断来的。
总之,ICIs继发耐药的真实情况在很大程度仍然不确定。
有限的临床报道表明,依靠常规的分子学检测手段可能不能揭示免疫治疗继发耐药的潜在机制,而是应该开发新工具更广泛和更深入的探索肿瘤微环境,宿主免疫系统和肿瘤之间的关系,去理解肿瘤免疫响应和有效性的功能和位置属性。系统的全基因组CRISPR/Cas9突变筛查已经识别了部分肿瘤免疫治疗的关键调节候选基因和通路,这对于理解继发耐药有潜在帮助。 单细胞测序也有助于进一步了解不同状态的T细胞的关键调控因子,可以评估免疫抗肿瘤效应和耐药的平衡状态,尤其可以更好的了解慢性抗原刺激下T细胞衰竭的潜在性能特点和机制,这对于预测响应模式和继发耐药后再次恢复T细胞响应会很关键。
- ICIs继发耐药是一个常见的临床现象,其详细机制仍不清楚。
- 对于原发耐药或继发耐药,开发下一代免疫治疗是非常有必要的,但成功的太少。
- 更深入了解潜在生物学机制,可以开发更多的治疗措施,部署ICIs之外的精确免疫疗法。
- 克服挑战,更深入了解ICIs继发耐药的潜在生物学机制需要多方协作努力。
- 新的进展最终能够促使未来开发合理的药物和细胞疗法去预防,规避或逆转ICIs耐药。
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)