三阴性乳腺癌简介
乳腺癌根据雌激素受体(ER)、孕激素受体(PR)及人表皮生长因子受体-2(HER-2)是否阳性分为三大类:激素受体阳性乳腺癌、HER2阳性乳腺癌和三阴性乳腺癌(TNBC)。
三阴性乳腺癌 (Triple-negative breast cancer;TNBC) 占乳腺癌的 10-15%,2020年新发TNBC就有6~8万例,它是一种严重侵袭和高度增殖的亚型,在年轻女性群体中占比更高。预后很差,大部分患者在三年后复发,在确诊前五年死亡。化疗仍然是早期和晚期TNBC患者的主要治疗手段,这是一个高度未满足的医疗需求领域,急需改善治疗方案和优化精准医疗。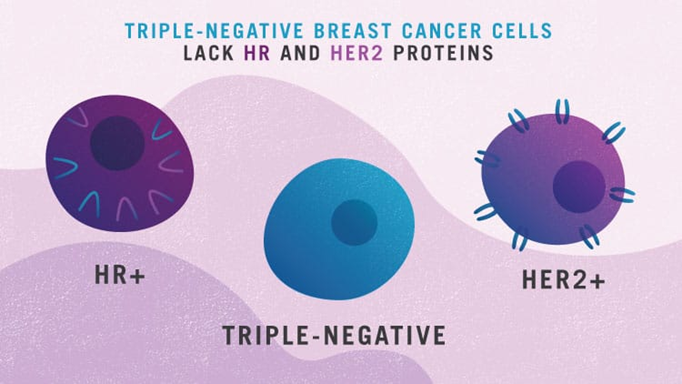
图片来源:https://www.gene.com
由于TNBC缺乏雌激素受体 (ER)、孕激素受体 (PR) 和人表皮生长因子-2 (HER-2)受体,故TNBC不能通过常规的靶向HER2疗法来治疗。从免疫学的角度来看,乳腺癌也被认为是一种“冷”肿瘤,然而,由于肿瘤浸润淋巴细胞的数量较多(更高的PD-L1表达;更高的肿瘤突变负荷),TNBC 已被证明是免疫治疗策略的首选亚型。
① Atezolizumab(TECENTRIQ,Genentech Inc.)联合白蛋白结合型紫杉醇
2019 年 3 月 8 日,FDA 加速批准 atezolizumab(TECENTRIQ,Genentech Inc.)联合白蛋白结合型紫杉醇用于 PD-L1 阳性不可切除的局部晚期或转移性三阴性乳腺癌。
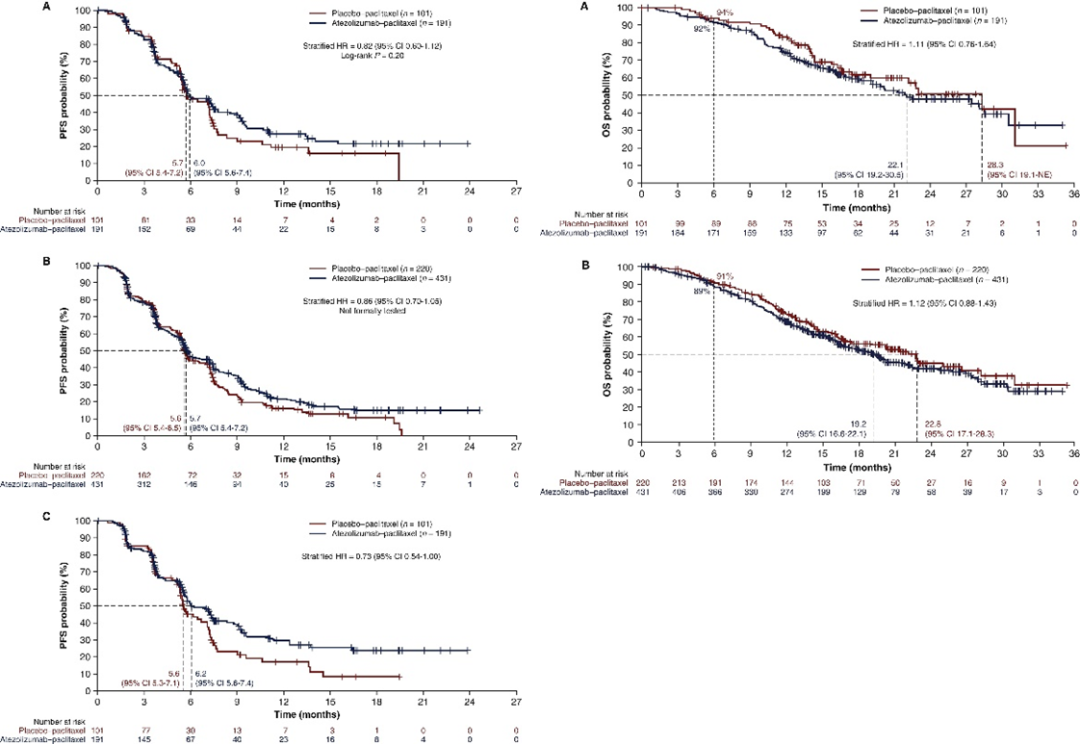
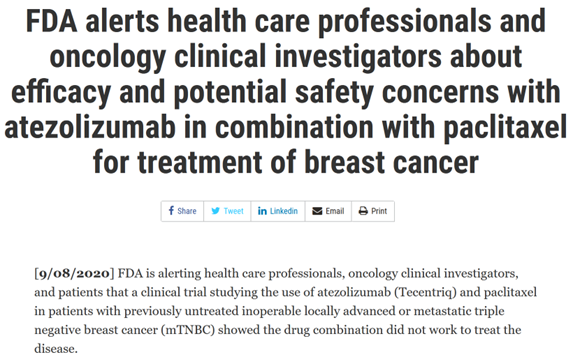
该批准基于 IMpassion130 (NCT02425891),这是一项多中心、国际、双盲、安慰剂对照、随机试验,包括 902 名未接受过化疗的不可切除局部晚期或转移性 TNBC 患者。在肿瘤表达 PD-L1 的患者中,接受 atezolizumab 与白蛋白结合型紫杉醇的患者的中位无进展生存期 (PFS) 为 7.4 个月 (95%CI:6.6, 9.2),而接受安慰剂与白蛋白结合型紫杉醇的患者的中位无进展生存期 (PFS) 为 4.8 个月 (95%CI:3.8, 5.5)。但总体生存数据不成熟,有 43% 的意向治疗 (ITT) 人群死亡。但在IMpassion131(NCT 03125902)临床试验中(atezolizumab联合白蛋白结合型紫杉醇上市后的验证临床试验),将 atezolizumab 联合紫杉醇与安慰剂联合紫杉醇用于 mTNBC 患者。在这项临床试验中,与安慰剂联合紫杉醇相比,在 PD-L1 阳性人群中,atezolizumab ;联合紫杉醇治疗并未显著降低癌症进展和死亡的风险。此外,在 PD-L1 阳性人群和总人群中,中期总生存期结果竟然有利于紫杉醇 + 安慰剂,而不是紫杉醇 + atezolizumab。 图注:与单独使用紫杉醇相比,atezolizumab 与紫杉醇联合使用并未改善 PFS 或 OS因此在2020年9月8日,FDA发出警告:在临床实践中,卫生保健专业人员不应用紫杉醇代替白蛋白结合型紫杉醇。这也间接导致罗氏自愿撤回该疗法在美国mTNBC适应症的决定,但该决定仅影响美国的mTNBC适应症,不影响美国境内atezolizumab和境外的其他已批准的适应症(包括mTNBC)。罗氏也表示将继续atezolizumab在mTNBC领域的探索。
② pembrolizumab联合化疗应用于局部复发性不可切除或转移性 TNBC2020年11月,FDA 批准 pembrolizumab(Keytruda, Merck)与化疗联合用于局部复发性不可切除或转移性 TNBC 患者(肿瘤表达 PD-L1(联合阳性评分 [CPS] ≥10))。
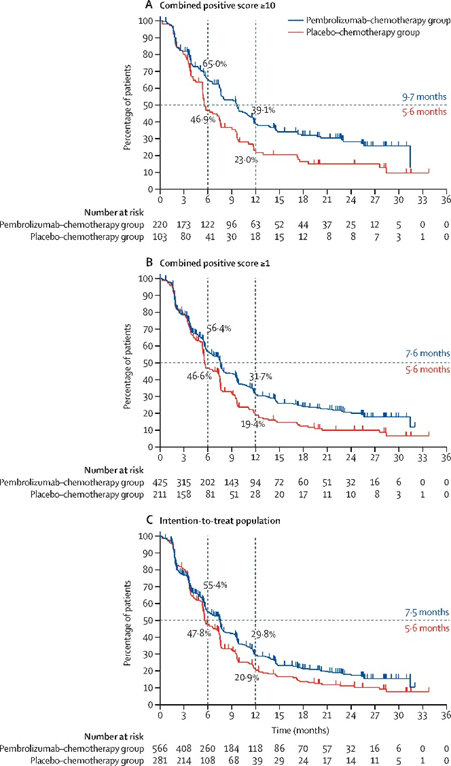
该项获批基于KEYNOTE-355(NCT02819518),一项随机、双盲、三期临床试验。在肿瘤表达PD-L1的局部复发不可切除或转移性TNBC患者中(联合阳性评分[CPS]≥10),pembrolizumab +化疗组中位PFS为9.7个月,对照组为5.6个月;此外,随着PD-L1 CPS的增加,这种差异更加明显。图注:KEYNOTE-355三期临床试验;不同分组中的无进展生存期分析
③ pembrolizumab联合化疗应用于高危、早期TNBC2021年7月,FDA批准pembrolizumab联合化疗作为新辅助治疗高危、早期、三阴性乳腺癌(TNBC),然后继续以单药治疗作为手术后的辅助治疗。
该项获批基于KEYNOTE-522 (NCT03036488) ,一项随机、多中心、双盲、安慰剂对照试验,纳入了1174 名患有新诊断的先前未经治疗的高危早期 TNBC(肿瘤大小 > 1 cm 但直径≤2 cm,淋巴结受累或肿瘤大小 > 2 cm而不考虑淋巴结受累)。患者被随机分配(2:1)接受派姆单抗联合化疗或安慰剂联合化疗。在试验结果中,派姆单抗联合化疗的患者的病理完全缓解率为64.8% (95% CI: 59.9, 69.5),而单独接受化疗的患者为 51.2% (95% CI: 44.1, 58.3)。在第四次中期分析(数据截止至2021 年 3 月 23 日)的中位随访时间为 39.1 个月。pembrolizumab联合化疗组在 36 个月时的无事件生存率为 84.5%(95% CI,81.7-86.9),而安慰剂组为 76.8%(95% CI,72.2-80.7)。FDA建议用药剂量:派姆单抗的推荐剂量为每 3 周 200 毫克或每 6 周 400 毫克,静脉输注>30 分钟。Pembrolizumab 联合化疗治疗 24 周,然后作为单一药物用于辅助治疗长达 27 周。图注:KEYNOTE-522 (NCT03036488)详细信息
④ ADC药物-戈沙妥珠单抗 “Sacituzumab govitecan”(Trodelvy®, Immunomedics Inc.)2021年4月,Sacituzumab govitecan被FDA获批用于已接受过至少2种疗法的不可切除性局部晚期或转移性TNBC成人患者,其中至少一种疗法用于转移性疾病。
2022年6月7日, Sacituzumab Govitecan在中国获批上市,用于转移性三阴性乳腺癌的二线治疗。这是云顶新耀获准在中国上市的首款创新药品,预计今年第四季度启动在中国的销售。Sacituzumab Govitecan最初由Immunomedics研发,2019年云顶新耀以6500万美元预付款+6000万美元FDA批准里程碑金额+7.1亿美元开发和销售里程碑金额获得Trodelvy日本以外的亚洲市场权益。Immunomedics则在2020年被吉利德以210亿美元收购。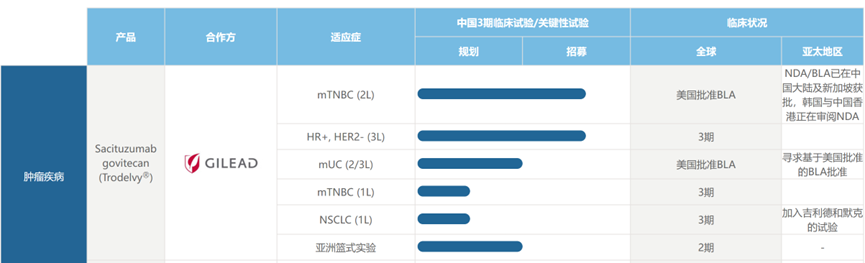
图注:云顶新药对戈沙妥珠单抗(Sacituzumab
Govitecan)开展的产品管线Sacituzumab govitecan由靶向TROP-2(人类滋养层细胞表面抗原 2)的人源化IgG1抗体与化疗药物伊立替康(一种拓扑异构酶I抑制剂)的代谢活性产物SN-38偶联而成,Trop2在85%的TNBC细胞上均表达。
该项获批基于Ⅲ期ASCENT临床试验(NCT02574455)。在至少接受过两种治疗的晚期TNBC患者中,Sacituzumab govitecan治疗组的PFS为5.7(4.3-6.9)个月,而单药化疗仅1.7 (1.5-2.6)个月;治疗组OS为12.1个月 (10.6-14.5) ,化疗组为6.9个月(5.2-8.6);治疗组ORR为34.0个月(28.0-40.5),化疗组为6.4个月(3.6 -10.4)。Sacituzumab govitecan治疗疗效显著优于化疗药物单用,这是第一个可提高mTNBC患者无进展生存期(PFS)和总生存期(OS)的疗法,标志着TNBC治疗方面的一个里程碑式的进步。FDA建议用药剂量:推荐的 sacituzumab govitecan 剂量为 10 mg/kg,一周一次,或者在 21 天治疗周期的第 1 天和第 8 天施用,直至疾病进展或出现不可接受的毒性。图注:Sacituzumab govitecan治疗组与化疗组的PFS和OS对比分析
近几年,免疫疗法,特别是抗体及抗体偶联药物,已在三阴性乳腺癌领域取得了阶段性突破,给这种异质性高、易复发、死亡率极高的肿瘤类型带来了希望,目前各种免疫疗法均在三阴性乳腺癌领域布局,包括抗血管生成抑制剂(含抗体和小分子蛋白)、双特异性抗体、CAR-T/NK等等,都值得关注,特别一提的是,联合疗法在三阴性乳腺癌领域显得尤其重要。
[2]Miles D, Gligorov J, André F,et al;Primary results
from IMpassion131, a double-blind, placebo-controlled, randomised phase III
trial of first-line paclitaxel with or without atezolizumab for unresectable
locally advanced/metastatic triple-negative breast cancer. Ann Oncol. 2021
Aug;32(8):994-1004.[3] O'Shaughnessy J, Brufsky A, Rugo HS, Tolaney
SM, Punie K, Sardesai S, Hamilton E, Loirat D, Traina T, Leon-Ferre R, Hurvitz
SA,et al.Analysis of patients without and with an initial triple-negative
breast cancer diagnosis in the phase 3 randomized ASCENT study of sacituzumab
govitecan in metastatic triple-negative breast cancer. Breast Cancer Res Treat.
2022 May 11.[4] Schmid P, Cortes J, Dent R,et al; KEYNOTE-522
Investigators. Event-free Survival with Pembrolizumab in Early Triple-Negative
Breast Cancer. N Engl J Med. 2022 Feb 10;386(6):556-567.版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。















发表评论
注册或登后即可发表评论
登录注册
全部评论(0)