2022-09-05 来源 : 重症医学
ICU COVID-19患者的液体管理
华北理工大学附属医院重症医学科 白静
重症行者翻译组
介绍
严重急性呼吸综合征冠状病毒2(SARS-CoV-2)引起的全球疫情大流行导致了世界范围的医疗紧急状况。由于SARS-CoV-2感染引起的2019年冠状病毒疾病(COVID-19)的患者可能会出现从无症状表现到多器官功能衰竭的多种临床表现。在危重患者中,呼吸系统主要受累。因COVID-19住院的患者中,约30%的患者可能发生急性呼吸窘迫综合征(ARDS),而病程中也可能累及其他肺外器官或系统。截至2020年3月,一项对中国五项研究的汇总分析显示,休克的发生率约为6%,并且在危重患者中的发生率更高(高达35%)。
COVID-19期间休克的机制可能是低血容量、梗阻性、心源性或分布性的。虽然这些机制各不相同,但液体治疗仍然是最重要的治疗方法之一。然而,在COVID-19合并休克的重症患者中,液体治疗较为棘手。一方面,液体治疗可提供足够的组织灌注;另一方面,也可能加重肺水肿,尤其是当血管通透性增加时,这是ARDS的一般规律。鉴于缺乏专门针对COVID-19的液体治疗策略的研究,致力于该疾病的拯救脓毒症运动(SSC)的建议是基于患有ARDS的非COVID-19人群中的现有证据。目前的建议是在COVID-19休克患者中使用保守的液体复苏策略,而不是自由式液体复苏策略。然而,我们确实对这一建议表示担忧。在本章中,我们将形成这样一种观点,即评估扩容的获益/风险比对于COVID-19和休克患者是必不可少的,并且液体治疗应该个体化。
为什么COVID-19患者会发生急性循环衰竭?
所有经典的休克机制均可导致COVID-19期间的急性循环衰竭,即低血容量、血管麻痹、左心或右心衰竭。
低血容量
最近的一项国际调查(1000名受访者)显示,根据超声心动图结果,在重症监护室(ICU)住院的COVID-19患者中,约有22%发生低血容量。COVID-19期间的低血容量可继发于多种机制。首先,患者可能会脱水,尤其是在入院时,因为发热、前几天的摄水量减少和液体丢失(腹泻、恶心等),或者有时是由于长期使用高流量鼻氧疗。其次,COVID-19患者可能由于对病毒攻击或继发细菌感染而出现全身炎症状态。由于对病毒攻击的反应或继发性细菌感染,COVID-19患者可能发生全身性炎症状态。它可导致内皮功能障碍,进而导致组织毛细血管渗漏,最终导致绝对血容量不足。它还可以导致静脉容量床增加,进而由于血液重新分配到非张力容量床而导致相对低血容量。
血管麻痹
在上述调查中,1000名受访者中,56%的人经常或非常频繁地使用血管加压药。血管麻痹可能是由于全身促炎状态引起,如果院内感染后发生感染性休克,则可更早发生或是更多地发生在较晚时间。继发性院内感染,特别是呼吸机相关性肺炎(VAP)在COVID-19患者中较为常见,可能比非COVID肺炎患者更常见。地塞米松和其他免疫调节剂是否为促进因素仍有待证实。继发于脓毒症的内皮功能障碍可引发广泛的外周血管扩张,并导致低血压。此外,使用大剂量镇静药物可导致全身血管扩张和低血压,这通常是为了患者适应呼吸机通气所必需的。
左心功能受损
与COVID-19相关的心肌损伤可由多种机制引起:通过不同途径直接的病毒损伤,如血管紧张素转换酶(ACE)2下调、细胞因子释放、微血管血栓损伤等。临床表现可能是严重的心律失常、严重的心力衰竭,有时还会出现心源性休克。根据一项对100名住院的COVID-19患者在入院24小时内进行的超声心动图研究,发现10%的患者有左室收缩功能不全,16%的患者有左室舒张功能不全。显然,在非COVID-19感染性休克中,除血容量减少和血管麻痹等其他机制外,左心功能障碍也可能与休克的严重程度有关。
右心室(RV)功能障碍或衰竭
根据一项使用超声心动图系统评估左右心脏功能的研究,在COVID-19期间,右室比左室更容易受损。在COVID-19 ARDS患者中,高达39%的病例发现右室功能障碍,伴或不伴右室扩张。一项回顾性研究显示,在ICU住院的第6天,51%的病例存在右室收缩功能障碍。右室功能受损是多因素的,可能是由于ARDS继发的肺血管阻力增加(血管收缩性炎性介质、缺氧性血管收缩等),或是由于正压通气相关的肺动脉高压(通常需要高水平的呼气末正压[PEEP])或是由于肺栓塞。肺栓塞在COVID-19患者中较为常见,尤其是在ARDS患者中,其发病率高于非COVID-19 ARDS患者。
液体治疗对COVID-19休克患者的影响
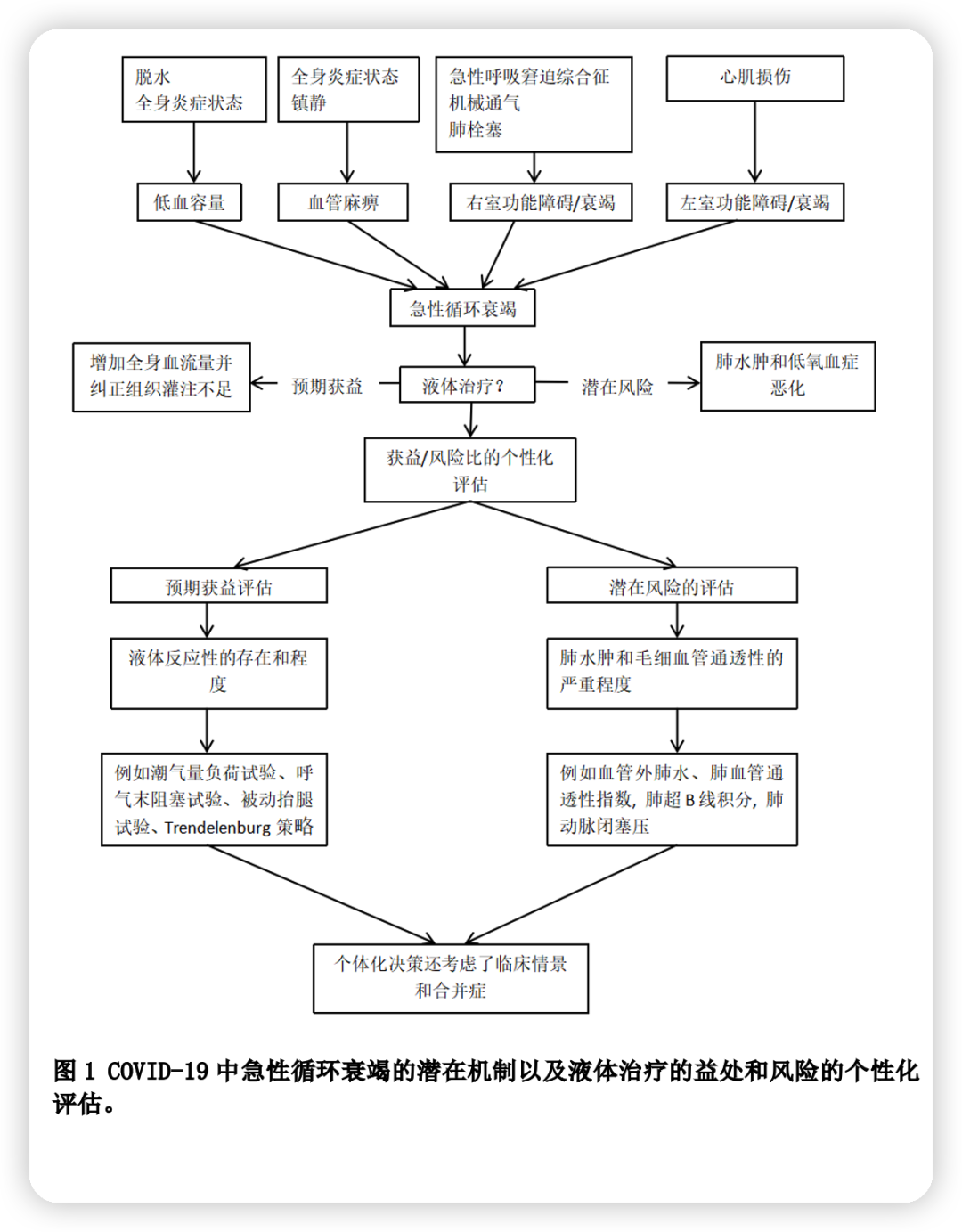
只有在休克和怀疑低血容量(绝对或相对)是急性循环衰竭的主要原因时,才应考虑液体治疗。
正如与其他临床情况一样,COVID-19期间低血容量可能导致全身血流量降低,这可能增加器官灌注不足的风险,并因此增加急性肾损伤和其他器官衰竭的风险。低血容量也增加血栓形成的风险,血栓形成在COVID-19中也很高。事实上,凝血病是常见的,且与SARS-CoV-2对内皮细胞的直接作用有关,导致纤溶酶原激活物的释放。肺微血栓可能导致通气/灌注(V/Q)失调和随后的低氧血症。其他器官的微血栓形成也可能导致多器官功能障碍或衰竭。最后,存在严重的肺内分流的情况下,低血容量导致的低心排可能通过低混合静脉血氧分压(PvO2)效应导致低氧血症恶化。如果血容量不足确实导致低血流量或血流量不足,所有上述效应均可能很明显,临床医生应考虑通过液体治疗来纠正这些影响。因此,液体疗法的预期益处是预防或纠正多器官衰竭的发展,并降低肺和其他器官微血栓形成的风险。此外,由于PvO2增加,增加心输出量可能改善动脉氧合。然而,这种获益作用尚不确定,因为与此同时,增加PvO2也可能增加肺静脉混合(或分流)。如果在ARDS中缺氧性肺血管收缩减弱,后一种效应(与PvO2增加相关的静脉混合/分流增加)也将减弱,并且在存在大量肺静脉混合或分流的情况下,随着PvO2的显著增加(与心输出量的显著增加相关),动脉氧合也显著改善。
另一方面,COVID-19经常与以肺泡上皮和内皮损伤为特征的ARDS相关。这导致肺毛细血管渗漏伴肺水肿、肺不张,最终,缺氧性肺血管收缩显著减弱,导致严重的V/Q不匹配。因此,伴有ARDS的COVID-19患者通常会出现严重的低氧血症。在这种情况下,液体治疗可能由于毛细血管渗漏而增加肺水肿的形成,有时也可能由于心输出量增加而加重V/Q不匹配。
如何评估液体治疗在COVID-19休克患者中的获益和风险?
在我们看来,由于重度ARDS经常存在,因此在COVID-19和休克患者,在进行任何液体治疗前,应仔细评估液体治疗带来的获益/风险比。这种评估应该是个性化的,因为不同患者和同一患者在不同复苏时期的获益和风险可能不同。在这方面,SSC的建议值得怀疑,因为建议使用保守的而不是自由的液体复苏策略。首先,“保守”和“自由”是含糊不清的词,可能会误导治疗决策。其次,该建议未考虑评估和决策的个体化,这是ICU患者任何复苏策略的关键原则。
为了充分评估液体治疗的获益/风险比,在做出决定之前,应该充分评估益处和风险,并将两者放在整体背景下进行考虑。这种益处不仅要通过是否存在来评估,更重要的是要通过液体反应的程度来评估。有大量证据表明,尽管持续休克,ICU患者可能对液体无反应,这可能是因为他们已经接受了液体和/或他们存在心功能障碍。还有大量证据表明,持续的液体正平衡与ICU患者的不良结局相关,尤其是在脓毒症和ARDS病例中。很明显,如果在最初复苏后休克仍持续存在,预测液体反应性对于那些不会从进一步液体治疗中获益,而是会经历有害影响的患者是有意义的。重要的是,液体反应性的存在是一种动态现象,在同一患者可能会随时间而变化。这表明,液体反应性的预测应该在需要治疗决定的时候进行测试。一项大型多中心脓毒症患者队列研究的结果表明,液体反应性试验的使用与改善生存率相关。在过去几十年中,已经制定了几项测试和指标。国际指南建议在普通重症患者以及COVID-19和休克患者中使用动态指标而非静态指标来评估液体反应性。
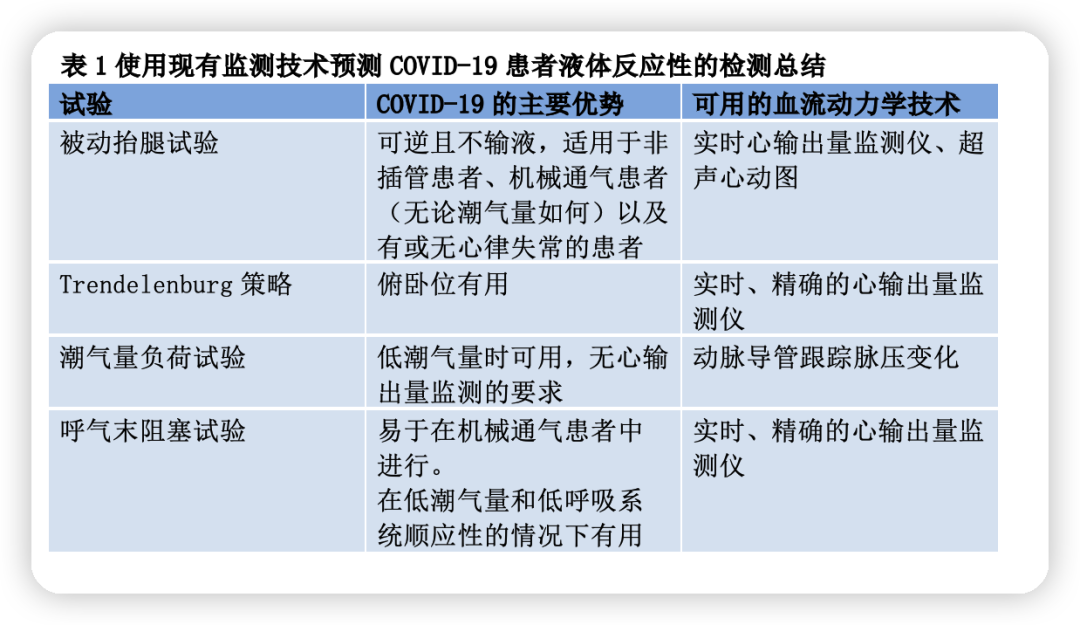
大多数液体反应性的动态指标或测试是基于机械通气患者的心肺交互作用(表1)。脉压变异率(PPV)是研究最多的变量之一,但其在实践中存在许多局限性。其中之一是低潮气量通气,常用于COVID-19 ARDS患者。为了克服这一限制,提出在低潮气量(6mL/kg)通气情况下进行潮气量负荷试验。Myatra等人表明,通过将潮气量从6mL/kg一过性增加到8 mL/kg,持续1 min,PPV绝对值(∆PPV)增加≥3.5%可以可靠地预测液体反应性。该结果在最近的一项研究中得到了证实,该研究表明,潮气量冲击期间PPV的增加可以可靠地预测低潮气量通气的脓毒性休克或ARDS患者的液体反应性。潮气量冲击对COVID-19 ARDS患者特别有帮助,这些患者通常被深度镇静并很好地适应呼吸机。重要的是,进行潮气量负荷试验无需心输出量监测设备,简单的动脉导管就足够了。
呼气末阻塞试验(EEOT)是另一种有用且易于操作的液体反应性试验。它甚至在心律失常或呼吸系统顺应性低的患者中也得到了验证,且与PEEP水平无关。通过在呼气末短暂中断呼吸机15秒,心输出量较基线增加≥5%可识别液体反应者。最近一项包括13项研究的荟萃分析表明,EEOT可预测液体反应性,受试者工作特征曲线下总面积(AUROC)为0.91(0.86-0.94),具有良好的灵敏度和特异性,阈值为5%。然而,由于EEOT是短暂的,且阈值相对较小,所以需要实时和精确的心输出量监测设备。
被动抬腿(PLR)是另一种广泛使用的成熟选择,因为它可以在几乎所有患者中进行,包括自主呼吸、房颤、低肺顺应性或低潮气量通气的患者。它模拟液体负荷,不需要任何液体。由于对心脏充盈压的影响是快速可逆的,因此不会增加肺水肿风险。大量研究一致表明,PLR是预测重症患者液体反应性的可靠测试方法。值得注意的是,由于PLR对心输出量的影响是短暂的,因此需要实时测量心输出量。PLR试验在腹内高压患者中存在假阴性。在缺乏心输出量评估的情况下,PLR期间PPV的降低是有帮助的,因为它被证明是预测液体反应性的可靠方法。对于有一些自主呼吸的镇静程度较低的机械通气患者中,我们的研究小组也表明,PLR期间PPV的降低可能是一个有价值的选择,因为它可以比单独PPV更好地预测液体反应性。
俯卧位经常应用于COVID-19 ARDS患者。在这种情况下,Trendelenburg动作(通过姿势动作动员静脉血液)被认为是可靠的液体反应性试验。ARDS俯卧位时其他动态参数或测试是否仍有效,有待进一步研究。
伴有ARDS的COVID-19患者接受液体治疗的风险是加重肺水肿和低氧血症。即使在液体反应性试验阳性的情况下,在给予休克患者输液前评估这种风险也很重要的。欧洲关于休克管理共识建议在休克患者中使用经肺热稀释法或肺动脉导管,尤其是在合并ARDS的情况下。在这种情况下,经肺热稀释系统可能是有帮助的,因为它们提供了血管外肺水(EVLW)和肺血管通透性指数(PVPI)的值。EVLW是肺泡和间质中积聚的液体量,是肺水肿的定量测量指标。PVPI计算为EVLW/肺血容量比。在非COVID-19 ARDS患者中,患者住院期间获得的最大EVLW值被证明是与死亡率相关的独立因素。PVPI的结果与之类似。在最近的一项研究中,我们发现EVLW和PVPI也是COVID-19 ARDS患者死亡率的独立预测因素。此外,我们还发现,与非COVID-19患者相比,COVID-19 ARDS患者有相似的肺部机制,但从发病开始时就有更高的EVLW和PVPI值。这与更差的动脉氧合以及更需要俯卧位和体外膜肺氧合(ECMO)相关。这些结果表明,COVID-19 ARDS可能与严重的弥漫性肺泡损伤和渗透性肺水肿相关。重要的是,我们发现在低氧血症程度相似的患者中,EVLW和PVPI值存在较大的异质性。例如,根据柏林定义,在重度ARDS患者中,在一些患者中测量到极高的EVLW和PVPI值,而在另一些患者中测到的值轻度升高。在前一种情况下,即使在有液体反应性的休克情况下,液体给药也是非常危险的,而在后一种情况下,可以尝试非常谨慎的液体给药。这种异质性证实,低氧血症的程度不能很好地反映肺水肿的严重程度,因此很难帮助COVID-19 ARDS患者实施个体化的治疗决策。
肺动脉导管也可用于休克和ARDS患者。在这种情况下,最有价值的变量之一是肺动脉闭塞压(PAOP),它是左心室充盈压的标志。如果PAOP很低,临床医生可能不太愿意在休克情况下输注液体,尽管PAOP作为血管压力不能作为肺水肿的直接估计。在这方面,在重症患者中未发现PAOP与EVLW之间的相关性。肺部超声是一种非侵入性方法,可以使用与EVLW相关的B线评分评估肺水肿。然而,这种评分仅提供了肺水肿的半定量评估,无法获得关于毛细血管通透性的有价值的信息。
总结
由于COVID-19休克患者通常伴有ARDS,因此推荐采用保守的液体策略,但不能完全丢弃液体治疗。治疗决策应在个性化评估液体输注的获益/风险比后做出决定。可使用液体反应性的动态指标来评估获益。需要考虑的不仅是液体反应性的存在,而且液体反应性的程度也是重要的考虑因素。例如,即使以下两种情况下都存在液体反应性,PLR期间心输出量增加25%,会使补液后心输出量增加的预期比PLR后心输出量增加12%的预期增加一倍以上。还应单独评价液体输注的风险。预测肺对液体输注耐受性的指标,如EVLW和PVPI可能与之相关。
除了仔细评估液体输注的获益/风险比外,临床情况也很重要。例如,对于给定的有利的获益/风险比,肾功能不全或高乳酸血症的重度循环衰竭情况,将鼓励临床医生考虑液体治疗。左心室收缩或舒张功能障碍也是一个重要因素,即使在获益/风险比有利的情况下,也可以避免或限制液体治疗。在这种情况下以及在所有其他休克状态下,超声心动图的表现对于评估心脏功能是至关重要的。
结论
对于伴有休克的COVID-19患者,无法给出液体治疗的共性建议。个体化仔细评估液体治疗的获益/风险比是必要对补液的比是必要的。
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)