前言

恶性肿瘤
已然成为全球面临的威胁人类健康的公共卫生问题,而肿瘤切除是治疗实体肿瘤的一种有效且使用广泛的方式。但实体肿瘤的切除通常只是肿瘤治疗中的“基础之战”,相当数量的癌症死亡则是由于术后残余的肿瘤细胞导致肿瘤复发和转移所造成的 [1, 2]。因此,为避免二次肿瘤侵袭带来的严重后果,越来越多的治疗方式致力于消除实体瘤切除后的参与肿瘤细胞,这对于癌症患者术后的有效恢复是至关重要的。
作者 | 三角形
大有前途的免疫疗法
传统的基于肿瘤术后治疗的辅助手段通常化学疗法(化疗,即化疗药物可以经过全身通过血液进入肿瘤组织,杀灭肿瘤细胞,从而达到消除肿瘤的作用)、放射治疗(放疗,即通过射线的作用对肿瘤细胞进行杀伤、杀灭,使肿瘤缩小甚至消失,达到消除肿瘤的目的)等等,但这些疗法往往会引起强烈的毒副作用,对患者的术后生活造成了极大的痛苦[3]。而免疫治疗作为新兴的肿瘤治疗手段近些年来逐步走进大众的视野,该疗法通过激活人体免疫系统,依靠自身免疫机能杀灭癌细胞和肿瘤组织。与以往的手术、化疗、放疗不同的是免疫治疗针对的靶标不是肿瘤细胞和组织,而是人体自身的免疫系统,该治疗方法具有持久性,且有效避免了传统治疗方式带来的毒副作用。
作为先天免疫的细胞成分中的重要一员,巨噬细胞(Macrophages)能够吞噬异物,并将携带的抗原呈递给T淋巴细胞(T cells),T细胞通过广泛接触进入体内的抗原物质,加强免疫应答,较长期保持免疫记忆,能够发挥细胞免疫及免疫调节等功能。而肿瘤细胞存在的免疫逃逸现象确是免疫治疗过程中的一大阻碍,即癌细胞可以通过上调整合素相关蛋白(Integrin-associated protein, IAP)--CD47来逃避巨噬细胞的识别,发出‘don’t eat me’信号,造成免疫治疗过程中的不利局面[4]。解决该问题的重要突破口就是阻断CD47与其配体信号调节蛋白α(signal regulatory protein-α, SIRPα)的相互作用从而增强巨噬细胞等吞噬细胞杀伤肿瘤细胞的作用。同时,肿瘤相关巨噬细胞(Tumour-associated macrophages, TAM)占肿瘤浸润性免疫细胞的很大一部分[5],其包含的两个不同的功能表型分别为在抗原提呈中起着关键作用,有利于肿瘤治疗的M1表型巨噬细胞(M1-like phenotype),和与肿瘤的侵袭、转移、血管生成、T细胞抑制和不良的临床结果相关的促肿瘤活性的M2表型巨噬细胞(M2-like phenotype)[6]。因此,将巨噬细胞从M2型转化为M1型在肿瘤免疫治疗中是至关重要的。
于是顾臻团队设计了一种可喷洒成胶的生物响应性免疫治疗纤维蛋白凝胶,该凝胶由抗CD47抗体(anti-CD47 antibody, aCD47)负载CaCO3纳米颗粒(aCD47@CaCO3)的纤维蛋白原溶液和凝血酶溶液构成,可以在手术后快速喷洒并混合在肿瘤切除腔内,形成原位免疫治疗纤维蛋白凝胶。纳米CaCO3可以在酸性和炎症的肿瘤微环境(tumor microenvironment,TME)中逐渐溶解和释放包裹的aCD47,从而促进M1型TAMs的激活,通过阻断CD47和Sirpα的相互作用并促进巨噬细胞吞噬癌细胞的抗肿瘤T细胞应答,同时减少与全身应用aCD47相关的毒性效应。包裹在纤维蛋白中的aCD47@CaCO3纳米颗粒清除手术伤口处的H+并释放aCD47,从而促进TAMs极化为M1样表型,并阻断癌细胞中的“不要吃我”信号,达到高效肿瘤免疫治疗的目的。
图1、原位喷洒水凝胶激活抗肿瘤免疫治疗设计思路图

水凝胶的原位免疫治疗
通过利用不同荧光标记的纤维蛋白原、CaCO3、aCD47的共聚焦图成功证明CaCO3纳米颗粒在凝胶中均匀分布,同时CaCO3与aCD47的荧光共定位进一步表明aCD47成功被包裹在CaCO3纳米颗粒中。而流变结果与扫描电镜(SEM)结果也共同证明了凝胶的顺利制备,体内荧光成像(in vivo imaging system, IVIS)结果显示凝胶能够在体内滞留15天以上,且在肿瘤酸性微环境中CaCO3纳米颗粒能够做到有效的响应而释放其中所包含的CaCO3纳米颗粒的存在能够有效缓解肿瘤酸性微环境,这对于修复由酸性环境造成的免疫细胞功能损害具有重要意义。因此作者研究了负载CaCO3纳米颗粒的纤维蛋白凝胶(CaCO3@fibrin gel)在肿瘤切除腔内铺展所引起的免疫效应。
流式细胞仪分析结果表明M2样TAMs(CD206hiCD11b+F4/80+)减少,M1样TAMs(CD80hiCD11b+F4/80+)增加,这意味着TME中酸性微环境的有效调节有利于M2样巨噬细胞极化为M1样巨噬细胞。在CaCO3@fibrin gel治疗后,还观察到TME中免疫抑制活性的髓系来源的抑制细胞(myeloid-derived suppressor cells, MDSCs) (CD11b+Gr-1+)和调节性T细胞(regulatory T cells, Treg)减少,以及低氧诱导因子1-ɑ(hypoxiainducible factor 1-ɑ, HIF1-ɑ)的表达减少,利于肿瘤细胞杀伤的肿瘤浸润性淋巴细胞(TIL,CD3+),特别是细胞毒性T淋巴细胞(CTL, CD3+CD8+),干扰素-γ(interferon-γ, IFN-γ)和肿瘤坏死因子-α(tumour necrosis factor-α, TNF-α)增加。
图2 、CaCo3@fibrin缓解肿瘤免疫抑制微环境

随后的CD47阻断实验也通过共聚焦成像和流式细胞术结果证明了其能够在体外增加巨噬细胞对癌细胞的吞噬,即CD47的阻断增强了巨噬细胞和树突状细胞对癌细胞的吞噬作用,激活了天然免疫系统。
图3、 aCD47体外及体外激活免疫反应

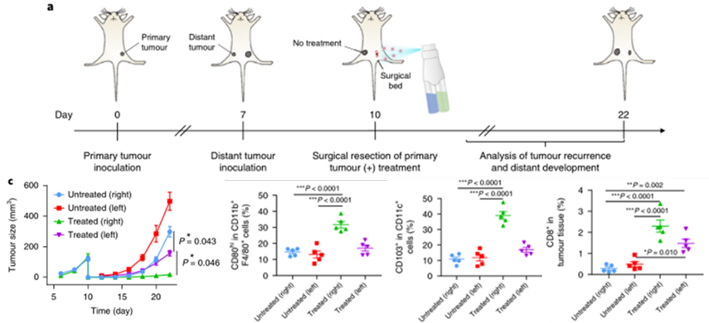
接下来的体内治疗作者使用了B16F10癌细胞的不完全肿瘤切除模型,使用具有不同载荷的原为喷洒水凝胶后结果表明,接受aCD47@CaCO3@ fibrin水凝胶治疗的小鼠显示出对肿瘤再生长的有效改善控制,且在显著延长肿瘤生存期的同时对小鼠体重没有明显影响,这也表明该凝胶的生物安全性良好。术后对小鼠肿瘤组织进行相关的检测也同样证实了aCD47@CaCO3@ fibrin水凝胶治疗组可以促进免疫抑制的TME逆转,并有效诱导免疫反应。
图4-5 aCD47@CaCO3@ fibrin体内抗肿瘤实验

最后,作者建立了B16F10肿瘤细胞的转移瘤模型,在原发瘤手术切除空腔内进行水凝胶喷洒治疗的同时观测转移瘤的生长情况。结果进一步证实了aCD47@CaCO3@fibrin能够有效激活免疫系统并抑制局部和远处肿瘤的生长。
图6 、 免疫抑制水凝胶对于转移瘤的实验
结 语
综上,这种简单的术后癌症免疫治疗策略能够在肿瘤切除部位原位喷洒形成的治疗凝胶,CaCO3纳米颗粒和aCD47抗体药物的联合使用在调节肿瘤酸性微环境的同时能以受控的方式释放治疗药物,从而促进抗肿瘤免疫反应。aCD47阻止了与癌细胞相关的‘不要吃我’信号,允许巨噬细胞清除癌细胞,有效避免肿瘤细胞的免疫逃逸现象。因此该治疗策略能够在促进免疫抑制的TME逆转的同时诱导全身免疫反应,有效抑制肿瘤复发和转移,这将为肿瘤切除后的临床应用提供一种新的治疗思路。

[1 ] Z. In situ formed reactive oxygen species-responsive scaffold with gemcitabine and checkpoint inhibitor for combination therapy. Sci. Transl. Med. 2018 , 10 , eaan3682.
[2] Turajlic, S.; Swanton, C. Metastasis as an evolutionary process. Science 2016 , 352 , 169-175.
[3] Albain, K. S.;Swann, R. S.;Rusch, V. W.;Turrisi, A. T.;Shepherd, F. A.;Smith, C.;Chen, Y.;Livingston, R. B.;Feins, R. H.;Gandara, D. R.;Fry, W. A.;Darling, G.;Johnson, D. H.;Green, M. R.;Miller, R. C.;Ley, J.;Sause, W. T.; Cox, J. D. Radiotherapy plus chemotherapy with or without surgical resection for stage III non-small-cell lung cancer: a phase III randomised controlled trial. The Lancet 2009, 374, 379-386.
[4] Michaels, A. D.;Newhook, T. E.;Adair, S. J.;Morioka, S.;Goudreau, B. J.;Nagdas, S.;Mullen, M. G.;Persily, J. B.;Bullock, T. N. J.;Slingluff, C. L., Jr.;Ravichandran, K. S.;Parsons, J. T.; Bauer, T. W. CD47 Blockade as an Adjuvant Immunotherapy for Resectable Pancreatic Cancer. Clin Cancer Res 2018, 24, 1415-1425.
[5] Lin, E. Y.; Pollard, J. W. Tumor-associated macrophages press the angiogenic switch in breast cancer. Cancer Res 2007, 67, 5064-5066.
[6] Neubert, N. J.;Schmittnaegel, M.;Bordry, N .;Nassiri, S.;Wald, N.;Martignier, C.;Tille, L.;Homicsko, K.;Damsky, W.;Hajjami, H. M. E.;Klaman, I.;Danenberg, E.;Ioannidou, K.;Kandalaft, L.;Coukos, G.;Hoves, S.;Ries, C. H.;Marraco, S. A. F.;Foukas, P. G.;De Palma, M.; Speiser, D. E. T cell-induced CSF1 promotes melanoma resistance to PD1 blockade. Sci. Transl. Med. 2018, 10. *
声明:推文用于传递知识,如因版权等有疑问,请于本文刊发30日内联系医药学术。原创内容未经授权,禁止转载至其他平台。
*推文用于传递知识,如有版权等疑问,请于本文刊发30日内联系BiG生物创新社。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)