在免疫反应在非酒精性脂肪肝中的作用,非HBV型HCC免疫治疗不获益机制?一文中曾经梳理过为何近年来在异质性非常强的HCC领域,众多免疫治疗方案已经获批适应症,但在亚组分析中,往往HBV-HCC患者免疫是最为获益的。而非酒精性脂肪肝型HCC患者往往无缘免疫治疗的获益的基础机制原因。当然,只是一家之言,也有可能翻车,但至少能解决我现在的知识困惑点,有兴趣的朋友可以移步前文细读。今天,想探寻的是HCV-HCC患者,对于免疫治疗的获益如何?背后的机制是什么?
原发性肝癌是目前我国发病率占第五位的常见恶性肿瘤,死亡率占第二位,根据世界卫生组织的年度预测,估计2030年将有100多万患者死于肝癌。是临床较为棘手的难治癌种。原发性肝癌主要包括肝细胞癌(HCC)、肝内胆管癌(ICC)、混合型肝细胞癌-胆管癌三种不同病理类型。本文主要讲解肝细胞癌(HCC)的相关研究进展。肝癌的致病病因,不同的国家有不同的主因,简单概括如下:- 相较于国外的治病因素,中国HBV感染导致的乙肝患者数量庞大。
- 而近年来,随着生活不健康方式的流行,非酒精性脂肪肝(NAFLD)导致的肝癌患者数量也逐年增加。
- 针对肝癌的高发因素,要提前进行疫苗的接种和生活方式的改变。因为,肝癌是非常凶险的,约80%的中国肝癌患者在确诊时已经进入中晚期,失去了手术治疗的机会。如果能够在发病早期就进行干预,则能有效阻止向肝癌的转化。随着新生儿乙肝疫苗接种和药物控制,形势有所缓和,但乙肝防治仍然任重道远。乙肝到肝硬化到肝癌三部曲,很多人也都不陌生。
- 与HBV感染患者相比,HCV目前已经有治愈的可能。直接抗病毒药物(DAA)的问世,使丙型肝炎的治疗取得了重大突破。DAA可获得较IFN(干扰素)更高的持续病毒学应答(SVR)、更短的治疗时间和更低的副作用,在全球已广泛使用,但其应用的有效性、安全性以及在特殊领域中的应用等问题引起了人们的关注。
- 谈到HCV的治疗,不得不提的就是吉利德,从丙肝药物索非布韦的上市,开启了丙肝治疗的新时代。索非布韦俗称“吉一代”,2013年底获FDA批准上市,针对2、3基因型慢性丙肝的治愈率超过90%。在此基础上,吉利德又相继推出了“吉二代”、“吉三代”、“吉四代”丙肝药物,覆盖了所有6种基因型的丙肝病毒,它们都能迅速阻断靶标病毒,最终使得丙肝成为一种可以治愈的疾病。
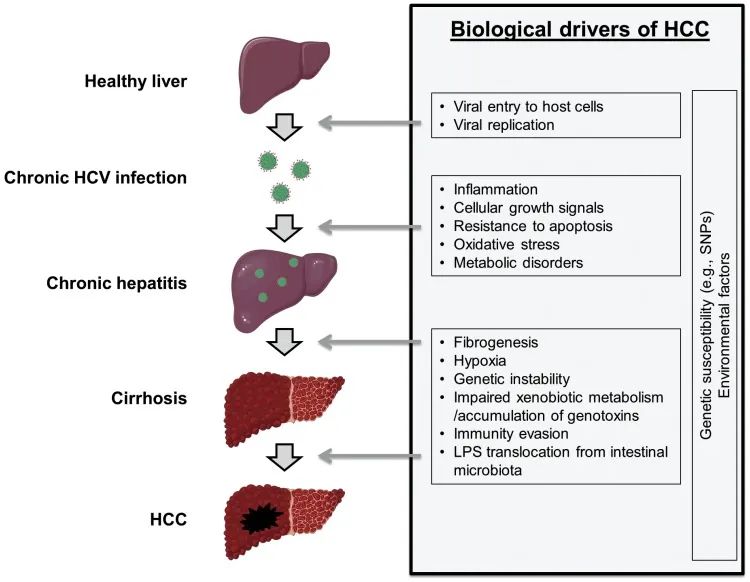
据世界卫生组织估计,全球有1.7亿人感染HCV。在我国健康人群抗HCV阳性率为0.7%~3.1%,约3800万人。由于病毒生物学特点和宿主免疫功能等多方面因素,机体免疫往往难以有效清除病毒,致使约50%~80%HCV感染者发展为慢性肝炎,其中20%~30%将发展成肝硬化。肝硬化患者中每年有1%~4%发展成为肝细胞癌症。- HCV是一种嗜肝、正链RNA病毒,具有高度的序列异质性。作为一种RNA病毒,HCV不能整合到基因组中,与周围的非肿瘤肝细胞相比,HCV不感染HCC肿瘤细胞,支持HCV不是直接致癌的结论。
- HCV感染可能通过一种旁观者机制产生一种致瘤环境,促进未感染肝细胞的细胞转化,如与Fusobacterium nucleatum核梭杆菌相关的结直肠癌和与幽门螺杆菌相关的胃癌。基于这些证据, HCV感染相关的HCC机制可以是直接的病毒诱导的细胞编程、间接的宿主相关炎症反应和重叠的宿主代谢旁观者效应。例如:HCV的基因产物(包括HCV核心蛋白、核心E1-E2、NS3和NS5蛋白等),已被证明可产生活性氧(ROS)或改变肝细胞miRNA表达,导致肝脏炎症和损伤。此外,丙型肝炎还与肝脏铁沉积有关,铁沉积的增加也可促进ROS的升高和HCC的发生
在慢性病毒性肝炎相关肝癌的发生过程中,HBV和HCV存在诸多共同的机制和途径,但因病毒本身属性和宿主免疫反应不同又存在致癌机制的不同。- HBV是一种嗜肝、部分双链的DNA病毒,HBV DNA序列可以整合到肝细胞基因组中,成为肝细胞及其祖细胞的永久组成部分,整合后可诱导基因组的不稳定性并破坏抑癌基因,从而促进肿瘤的发生。
- HBV具有直接致癌潜力。例如,HBV感染原代细胞后,可上调参与细胞周期的宿主因子表达,包括PPARA、RXRA和CEBPB等。其次,一些HBV蛋白被认为是潜在的“病毒癌蛋白/ viral oncoproteins”,可以直接驱动HCC,包括HBsAg、核心抗原(HBcAg)和X蛋白(HBx)等。
HBV和HCV所致的肝细胞损伤大部分由宿主免疫反应介导。- 例如在早期免疫应答中,CD8+ T细胞通过直接损伤病毒感染的肝细胞并分泌干扰素和肿瘤坏死因子来抑制病毒。
- 有研究证实,肝脏微环境中的免疫细胞也能够降低机体的抗肿瘤活性。例如,调节性T细胞、肝窦内皮细胞和肝星状细胞都能导致肿瘤细胞的免疫逃逸。
- 天然免疫在通过干扰素和炎性细胞因子的分泌抑制病毒的同时,也会引发胞嘧啶脱氨酶家族基因表达。该家族基因APOBEC3A和APOBEC3B能够降解HBV cccDNA。然而,胞嘧啶脱氨酶的表达也能够促进HBV的免疫逃逸和促进肿瘤体细胞突变的产生。
- 慢性炎症所导致的细胞损伤能够加速肝细胞再生,而肝细胞再生和氧化应激则会进一步加重细胞DNA损伤和突变累积。随着宿主免疫系统的逐步激活,免疫激活期的CHB患者发生肝癌的风险要高于免疫耐受期患者。HBV和HCV的组装和成熟都发生在内质网中。研究表明,大量的表面抗原(HBsAg)可在感染肝细胞的内质网中积聚,激活肝细胞的未折叠蛋白反应通路(UPR),导致DNA损伤和基因组的稳态失衡。HCV RNA在内质网中的复制及病毒在内质网膜上的锚定,同样可以激活肝细胞UPR,进而导致肝纤维化和HCC。
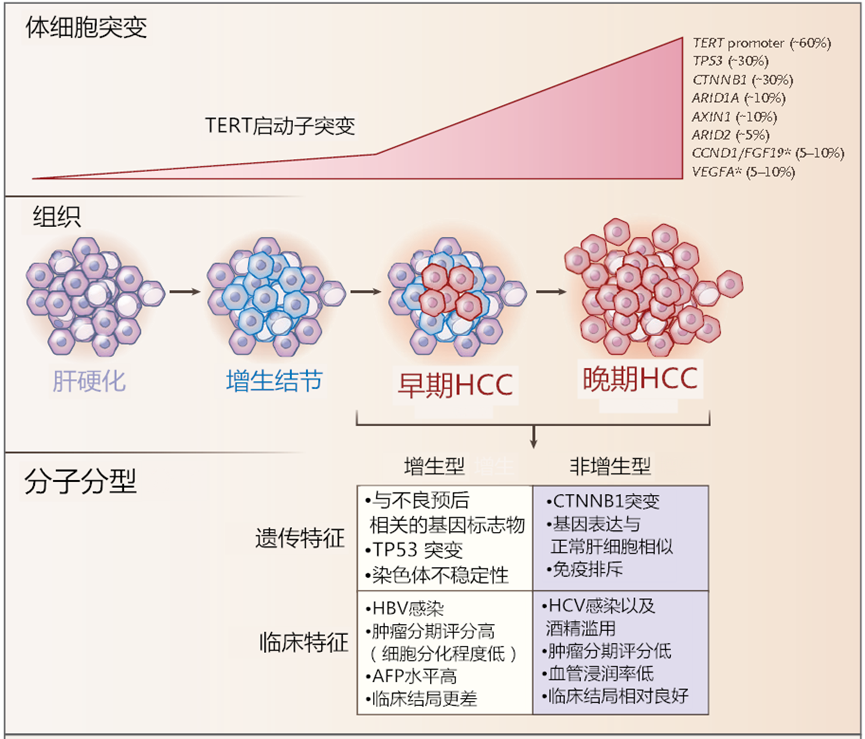
上面的各项证据的累积,纷繁复杂,今天只想聚焦一个于临床治疗获益程度密切相关的点,那就是肝纤维化程度。无论潜在的肝纤维化程度如何,HBV感染都有直接的致癌作用,但在HCV感染者中,若不伴有重度肝纤维化,则HCC很少发生(慢性丙型肝炎感染可导致脂肪性肝炎,从而加速纤维化和肝硬化)。具体罗列如下:慢性肝病患者存在持续性肝脏炎症、肝纤维化和肝细胞异常再生。这些异常的生理过程可导致肝硬化,并导致一系列遗传学和表观遗传学事件,最终导致异常增生结节(真正的肿瘤癌前病变)的形成。额外的分子改变能使异常增生细胞获得增殖、侵袭性和生存优势,并完成到成熟HCC的转变。HCC也可发生于不存在肝硬化或明显炎症的慢性肝病患者(如HBV感染患者)。 上图具体描述了人HCC发生过程中关键的分子和组织学改变,以及HCC两个分子亚型的主要遗传和临床特征。*表示高水平的DNA扩增。在非增生型中,CTNNB1突变增强了免疫排斥。本身处于肝损伤状态的HCC患者,在使用激活T细胞的免疫检查点抑制剂方面,就需要密切关注肝功能状态。- 免疫检查点抑制剂,如PD-1抗体,在阻断PD-1途径的过程中可激活抗病毒相关的免疫反应并诱导肝细胞损伤。例如,在一些HBeAg阴性的CHB和CHC患者中,PD-1阻断后会出现ALT升高。
- 血管内皮生长因子(VEGF)抑制剂可以抑制肿瘤血管生成,是常用的抗肿瘤药物之一。
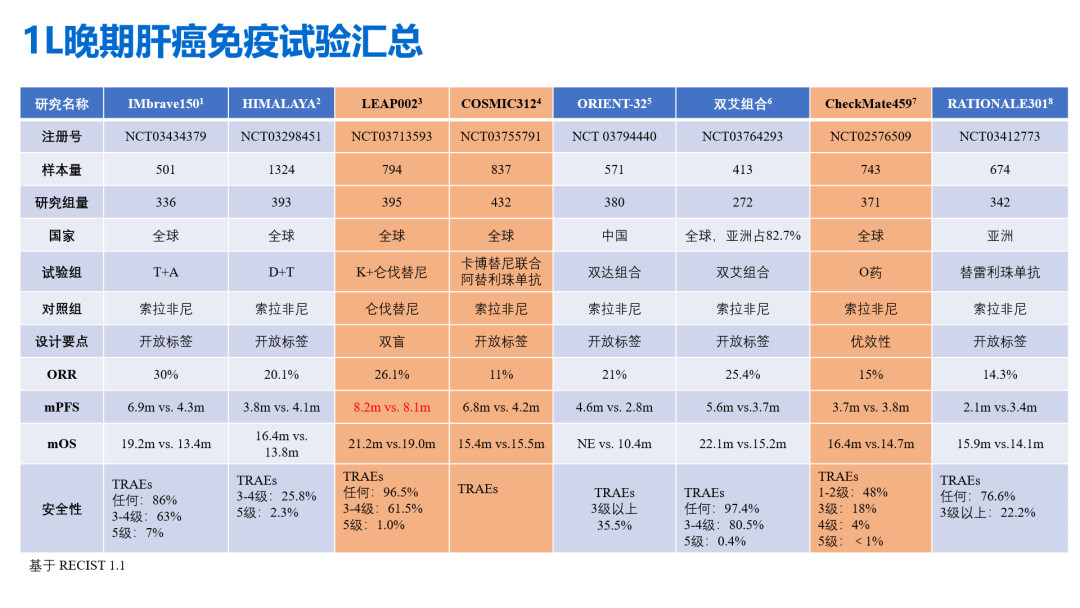
- 靶免联合方案已经成为HCC治疗的标准方案之一,在带来生存期获益的同时,也要关注到不良反应的发生率较高(下图所示,靶免方案,3-4级的TRAEs普遍在50%以上)。这表明,在进行肝细胞癌的治疗前,需要充分评估患者的肝功能储备,并通过抗病毒治疗减少病毒因素诱发的肝脏负担。
通过上述表格的统计,也发现一个非常有意思的现象,那就是索拉非尼并不是一个非常弱的药物,mPFS和mOS的数据一直在刷新,是个遇强越强的狠角色。排除掉索拉非尼对照组后线接受挽救治疗的比例和最佳支持治疗等对长生存获益数据的拉高外,从机制本身能不能阐述。
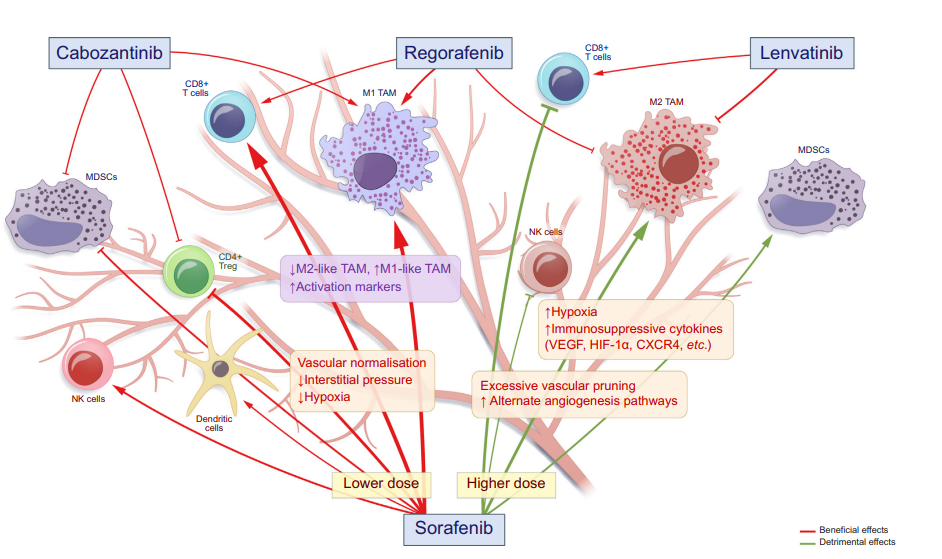
在批准的HCC MKI(多激酶抑制剂)中,索拉非尼的免疫调节作用最为广泛。体内和体外研究表明,索拉非尼可通过增加TAM的M1极化增强CD4+和CD8+T细胞浸润和功能、抑制Treg数或逆转肿瘤微环境中MDSC的功能来增强抗肿瘤免疫。其他MKI(仑伐替尼、瑞戈非尼和卡博替尼)也在各种临床前模型中显示了抗肿瘤免疫活性。尽管许多免疫调节作用可能与这些MKI的VEGFR抑制特性有关,但肿瘤微环境中的多种细胞和可溶性因子可能介导其免疫调节作用。因此,关键免疫介质的鉴定对于更全面的机制探索至关重要。多激酶抑制剂可能通过血管生成依赖性和独立性机制调节抗肿瘤免疫- 多个免疫细胞可能参与这些机制。索拉非尼的作用可能是剂量依赖性的:较低剂量更有可能诱导血管正常化、减少缺氧和提高抗肿瘤免疫(有益效果)。相反,更高的剂量可能矛盾地增强缺氧并促进免疫抑制(有害影响)。其他多激酶抑制剂(瑞戈拉非尼、乐伐替尼和卡博扎丁尼)的剂量效应值得进一步研究。
更好地理解抗肿瘤免疫和irAE之间的机制相互作用不仅将改善irAE的管理,而且有助于开发具有更好治疗指数的ICI方案。在发生irAE的患者中一般抗肿瘤效果较好,这或表明诱导
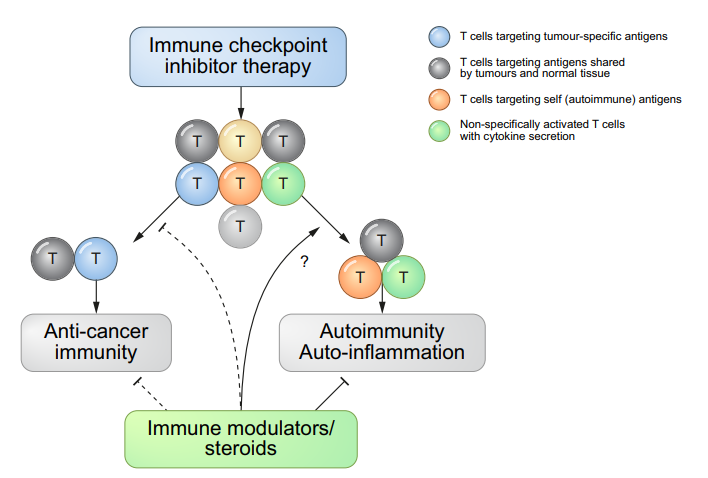
抗肿瘤免疫与自身免疫不良反应之间存在共同机制免疫检查点抑制剂治疗导致的irAE与抗肿瘤免疫的机制和相互作用- 诱导抗肿瘤免疫和自身免疫反应可能涉及靶向共享抗原的T细胞(黑圈)。irAE的诱导也可能涉及由自身抗原(橙色圆圈)或非特异性T细胞相关炎症(绿色圆圈)激活的T细胞。
- 免疫调节剂或低剂量类固醇方案的使用可能不会显著损害免疫检查点抑制剂诱导的抗肿瘤免疫(由虚线表示)。可以在不损害抗肿瘤活性的情况下制定irAE预防和治疗策略(用实心箭头表示)。
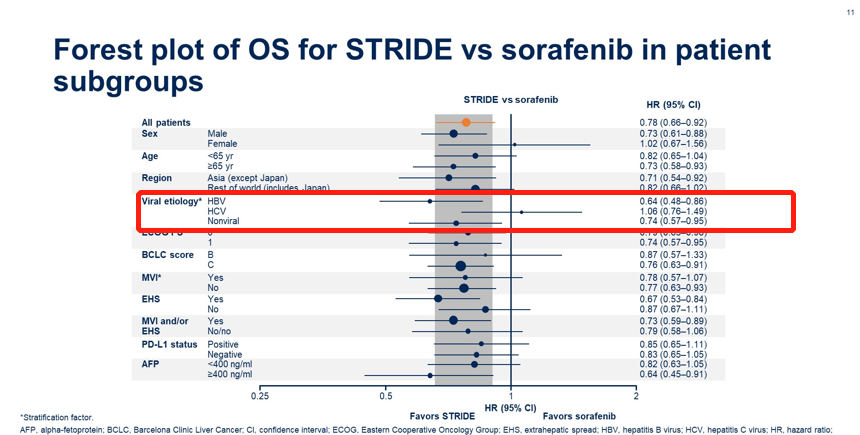
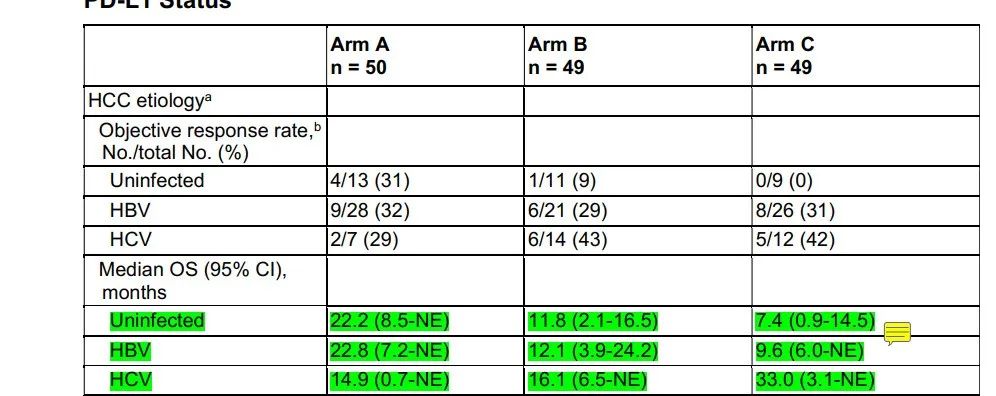
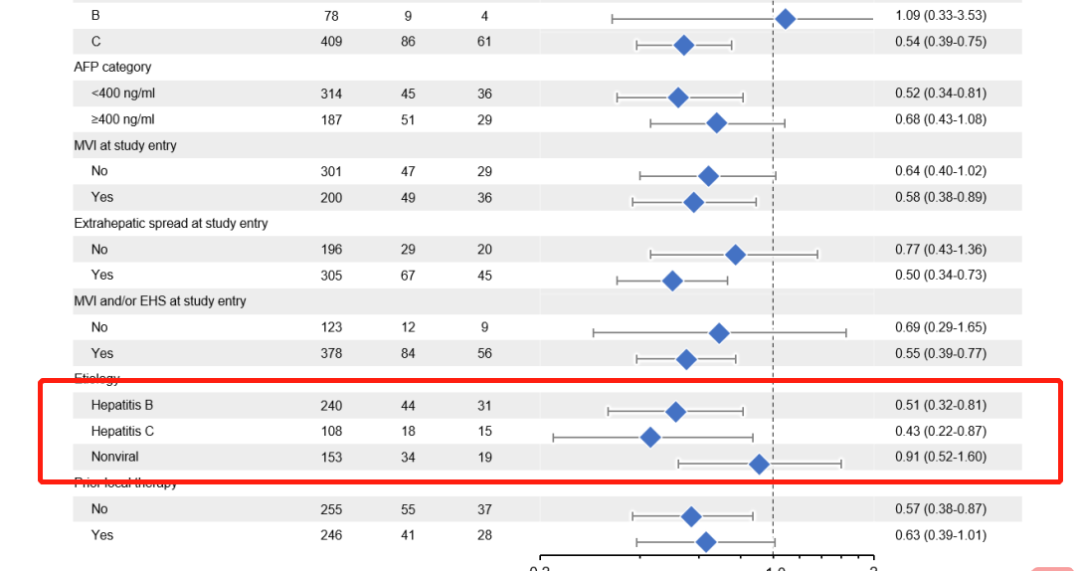
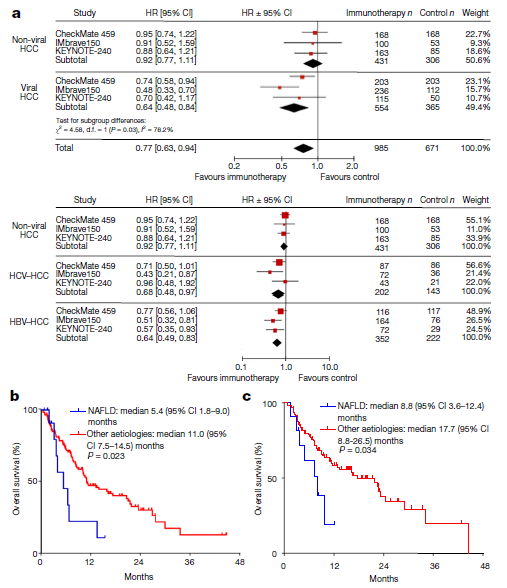
虽然高剂量类固醇仍然是3–4级irAE的主要药物,但已经研究了其他方法来治疗或预防irAE,而不妨碍抗肿瘤免疫。最常用的方法是使用TNFα抑制剂英夫利昔单抗治疗类固醇治疗无效的irAE。临床前模型表明,预防性TNFα阻断可预防由抗PD-1/抗CTLA4组合诱导的irAE,而不会对抗肿瘤活性产生负面影响。细胞毒性化疗前的短疗程地塞米松可能会增加Tregs的增殖和活化,并维持CD8+与外周调节性T细胞的比例,这表明在ICI治疗前,通过合并短疗程类固醇治疗可以预防irAE。——HCV-HCC与HBV-HCC免疫获益程度不同?——本文失败的一点是,对于HCV型HCC和HBV型HCC,下面的三项研究(HIMALAYA、O+Y、IMbrave150)的亚组分析中,免疫获益程度是不一样的。
而在既往的mata分析中,下图所示,HCV-HCC和HBV-HCC的获益似乎又一致。从上述我们提到的肝纤维化程度和肝脏损伤程度上,能解释通吗?啧啧,肝癌,高度异质性的癌种,终归还是有太多迷惑之处等待解决。- Clinical and Molecular Hepatology 2015; 21(2): 105-114.
- J Hepatol. 2020 Feb;72(2):307-319.
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。






发表评论
注册或登后即可发表评论
登录注册
全部评论(0)