前言
Enhertu®,Daiichi Sankyo,也称为DS-8201或T-DXd,也许是最被业内所熟识的一款ADC药物。
自DS-8201获批问市后,一路披荆斩棘,不仅在传统适应症上对T-DM1形成碾压优势,还开辟了乳腺癌HER2低表达这一亚型的适应症。
DS-8201似乎既是HER2 ADC热潮的引领者,也有可能成为同类靶点的终结者。那么今天,小编将带大家细数DS-8201的临床试验,看看DS-8201是如何在同类产品中一路过关斩将,并且在未来还有那些布局。
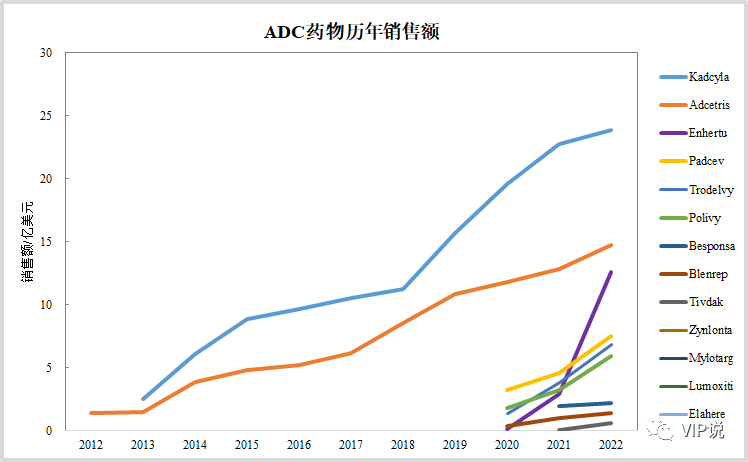
截至2023年一季度,FDA累计批准13款ADC新药。DS-8201今年将突破20亿美元成为超级重磅炸弹,超过kadcyla成最畅销ADC已无悬念。
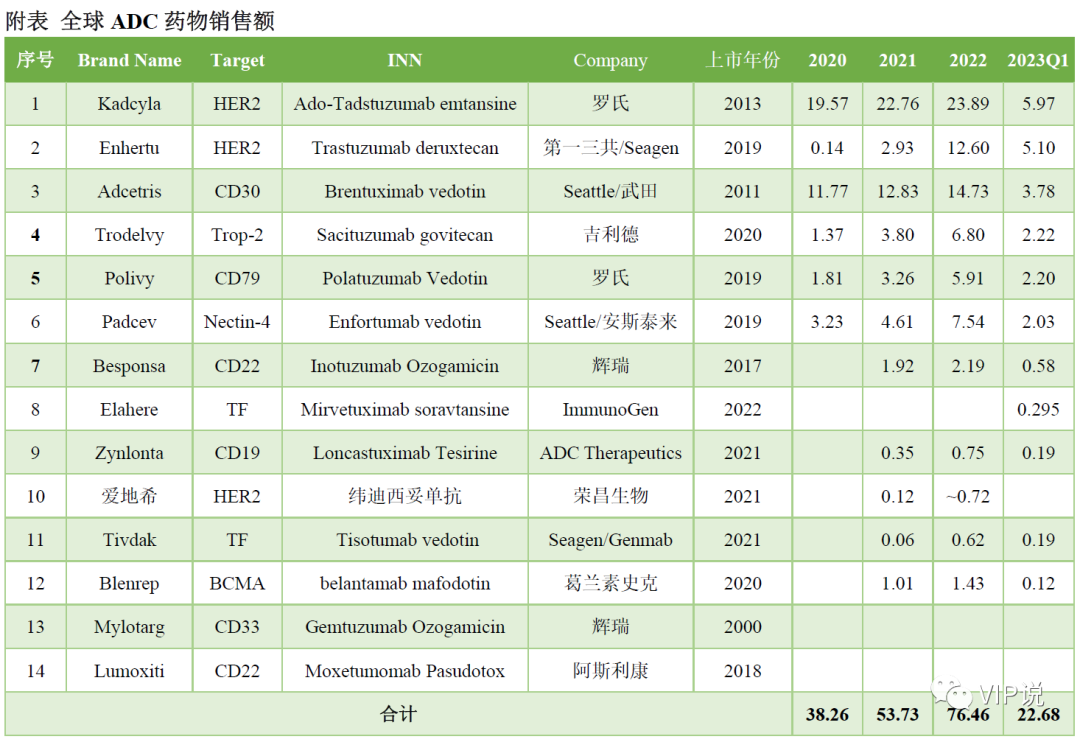
Trop2 ADC和Nectin-4 ADC今年也将大概率超过10亿美元。血液瘤的Adcetris、Polivy同样处于快速增长阶段,后者今年也将大概率突破10亿美元。
DESTINY-Breast系列研究
DESTINY-Breast01:华丽亮相,拿下FDA通行证
2019年,基于DESTINY-Breast01研究,FDA批准DS8201用于HER2阳性乳腺癌的后线治疗。II期Destination-Breast01关键研究(NCT03248492)评估了曾接受过T-DM1治疗的HER2阳性转移性乳腺癌成年患者。该研究的第一部分评估了三种不同剂量的T-DXd,以确定推荐剂量(5.4、6.4和7.4 mpk);第二部分评估了推荐剂量(5.4 mpk)的疗效和安全性。之前已经进行中位数6次治疗的184名患者,接受了5.4 mpk的T-DXd (每3周一次),ORR为60.9%。中位有效时间为14.8个月,中位PFS为16.4个月。截止2020年6月8日的数据,中位随访20.5个月,37名患者(20.1%)仍在接受治疗。中位DOR为20.8 个月;PFS为19.4 个月(95%CI,14.1 mo-NE);确认的ORR为61.4%(12个CR),DCR为97.3%(95%CI,93.8-99.1)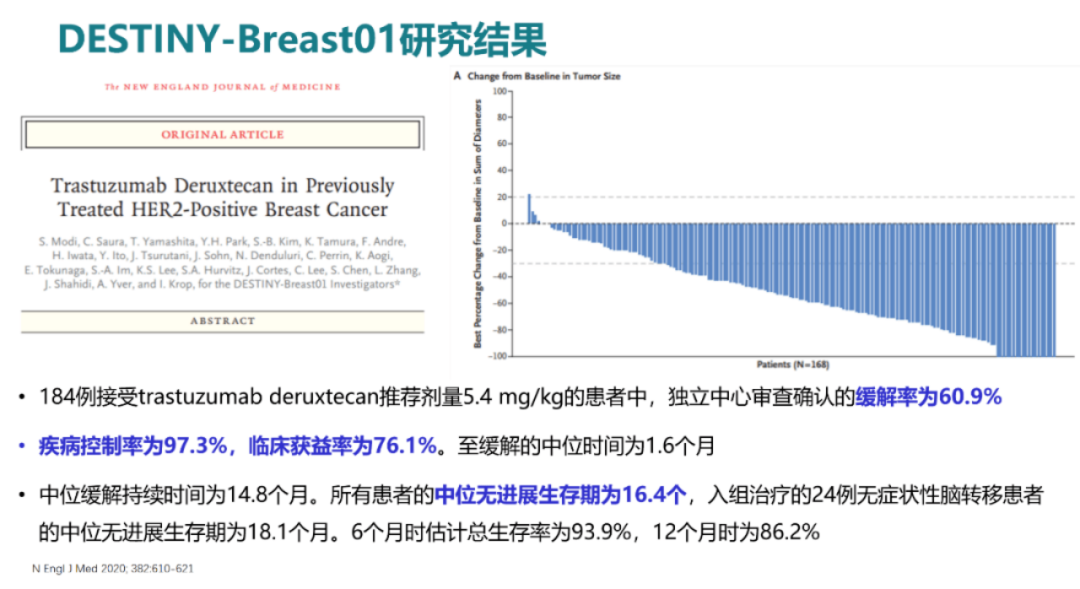
DESTINY-Breast02:喜提转移性乳腺癌PFS和OS双阳结果
DESTINY-Breast02为多中心、开放标签的III期研究,纳入600例T-DM1经治的HER2阳性不可切除和(或)转移性乳腺癌患者,探索了DS-8201a(5.4 mg/kg,q3w)较研究者选择方案(曲妥珠单抗+卡培他滨或拉帕替尼+卡培他滨)的差异。主要研究终点为无进展生存期(PFS),次要研究终点为总生存期(OS)。研究结果显示,T-DXd显著延缓了HER2阳性转移性乳腺癌患者的疾病进展。T-DXd在DESTINY-Breast02研究中的安全性与之前的试验一致,没有发现新的安全性问题。间质性肺病(ILD)的发生率和严重程度与在其他转移性乳腺癌试验中观察到的一致,经独立评审委员会确认的5级ILD事件发生率较低。
DESTINY-Breast03 :头对头T-DM1,稳固二线治疗地位
DESTINY-Breast03研究是首个头对头对比ADC药物(DS8201和T-DM1)治疗HER2阳性晚期乳腺癌疗效与安全性的一项多中心、开放性、随机、Ⅲ期临床研究。入组患者为经过曲妥珠单抗或一种紫杉类治疗的不可切除或转移性HER2+乳腺癌,且允许经治疗后稳定的脑转移患者,主要终点是BICR评估的PFS,次要终点为OS、BICR和研究者评估的ORR和DOR、研究者评估的PFS。DS8201组的中位PFS尚未达到,T-DM1组的中位PFS为6.8个月,(HR 0.28,95%CI 0.22-0.37),相较于T-DM1降低72%的疾病进展风险。DS8201组和T-DM1组患者12个月的预估OS率分别为94.1%(95%CI,90.3-96.4)和85.9%(95%CI,80.9-89.7),HR为0.56(95%CI,0.3587-0.8576;P=0.007172,未超过预先设定的显著性界值)。基于该结果,FDA也正式批准DS8201的二线适应症。
DESTINY-Breast04研究:HER2低表达被重视,重新定义治疗标准
DESTINY-Breast04是第一个聚焦于HER2低表达领域且获得阳性结果的3期试验。入组患者为不可切除或转移性HER2低表达(IHC2+/ISH-,或IHC1+)、经过1~2线化疗的晚期乳腺癌患者,随机接受T-DXd标准剂量或研究者选择的化疗(大约相当于经过靶向或内分泌治疗的2/3线及后线化疗)。主要终点是BICR评估HR+患者的PFS;次要终点为所有患者的PFS、HR+和所有患者的OS、ORR、DOR等。DESTINY-Breast04共入组HER2低表达晚期乳腺癌化疗失败患者557例,按2∶1的比例随机分为两组:DS-8201(5.4 mg/kg)组373例、医生选择化疗(TPC)组184例,其中HR+494例(88.7%,DS-8201组331例、TPC组163例)、HR-63例(11.3%)。主要终点为HR+患者的无进展生存(PFS)。关键次要终点为全部患者(FAS;HR+/−)的PFS、HR+患者和全部患者的总生存(OS)。中位随访时间为18.4个月(95% CI:17.9-19.1)。在HR+队列中,与TPC相比,DS-8201将患者疾病进展或死亡风险降低49%(HR=0.51,95% CI:0.40-0.64;P<0.001),DS-8201组和TPC组的中位PFS分别为10.1个月和5.4个月。DS-8201还将死亡风险降低了36%(HR=0.64,95% CI:0.48-0.86;P=0.003),两组的中位OS分别为23.9个月和17.5个月。在全体患者中,与TPC相比,DS-8201将患者疾病进展或死亡风险降低50%(HR=0.50,95% CI:0.40-0.63;P<0.001),DS-8201组和TPC组的中位PFS分别为9.9个月和5.1个月。DS-8201还将死亡风险降低了36%(HR=0.64,95% CI:0.49-0.84;P=0.001),两组的中位OS分别为23.4个月和16.8个月。在HR-队列中,与TPC相比,DS-8201将患者疾病进展或死亡风险降低54%(HR=0.46,95% CI:0.24-0.89),两组中位PFS分别为8.5个月和1.9个月;DS-8201组较TPC组死亡风险降低了52%(HR=0.48,95% CI:0.24-0.95),两组中位OS分别为18.2个月和8.3个月。值得一提的是,这一患者群体传统上被定义为三阴性乳腺癌。DESTINY-Breast04结果显示,与标准治疗相比,无论HR状态如何,患者的PFS和OS均有统计学显著和临床意义显著的获益,且总体安全可控。DESTINY-Breast04是第一个针对HER2低表达患者并获得阳性结果的III期临床试验,这一里程碑式的突破意味着DS8201或将为过半数乳腺癌患者带来全新治疗模式。基于该结果,FDA也于正式批准DS8201的治疗HER2低表达的适应症。
DESTINY-Breast05:剑指高危早期HER2+乳腺癌,强化辅助或再立新标
DESTINY-Breast05是一项多中心的,随机的,Ⅲ期临床试验,旨在评估DS8201与T-DM1新辅助治疗高危或有残留浸润性淋巴结的HER2阳性原发性BC患者的疗效。研究在全球约400个中心招募了约1600名患者,1:1随机分为DS8201(每3周静脉注射5.4 mg / kg)或T-DM1( 3.6 mg / kg)治疗。研究的主要终点是无浸润疾病生存,次要终点是无复发疾病生存和安全性等。
DESTINY-Breast06:挑战HER2超低表达,继续前移治疗线序
DESTINY-Breast06是一项全球性,随机,多中心,开放的Ⅲ期临床试验。评估了DS8201联合化疗治疗内分泌进展的HR +、HER2低表达转移性乳腺癌的疗效和安全性。除了正在研究的HER2表达患者之外,该试验还将研究DS8201在IHC> 0 ,<1+人群中的疗效和安全性。全球300个中心的850名患者(HER2低表达,n = 700;IHC> 0 <1 +,n = 150),患者均接受过二线及以上内分泌治疗方案且进展,不能接受过针对转移性疾病的化疗或任何抗HER2的治疗。患者以1:1的比例随机分配,每3周接受DS8201 5.4 mg / kg或者接受研究者选择的化疗(紫杉醇,白蛋白紫杉醇或卡培他滨)。主要终点是HER2低表达人群的PFS。次要终点是HER2低表达和意向性治疗(ITT, HER2低表达和HER2 IHC> 0 <1+)人群的OS,以及ITT人群的PFS等。
DESTINY-Breast07:联合治疗HER2+乳腺癌的多模式探索
DESTINY-Breast07是一项评估DS8201联合用药在HER2阳性晚期或转移性乳腺癌患者的安全性和初步抗肿瘤活性的1b / 2期临床试验。该研究的第一部分(剂量探索)包括T-DXd+度伐利尤单抗、帕妥珠单抗、紫杉醇、度伐利尤单抗+紫杉醇、图卡替尼等5个模块;第二部分(剂量扩展)则包括T-DXd单药、前述5个模块以及T-DXd单药或联合图卡替尼用于活动性脑转移患者等8个模块(0-7模块)。主要终点是安全性和耐受性,并确定2期推荐剂量(RP2D)。2022年ASCO大会报道了T-DXd+帕妥珠单抗的剂量探索结果,确定该方案的RP2D(T-DXd 5.4 mg/kg Q3W+帕妥珠单抗420mg;帕妥珠单抗负荷剂量840mg),7例患者中有5例(71.4%)仍在治疗中,2例(26.8%)治疗中断(撤回知情和射血分数降低各1例);3例(42.9%)≥3级AEs,没有间质性肺病(ILD)/非感染性肺炎或剂量限制毒性(DLTs)发生,无死亡事件。
DESTINY-Breast08:联合治疗HER2+低表达乳腺癌的多模式探索
DESTINY-Breast08是一项多中心,开放标签,两部分的研究,评估DS8201联合治疗HER2低表达,HR +/HR- MBC的患者的安全性,耐受性和药代动力学。
DB-08研究与DB-07设计相似,但入组患者为HER2低表达晚期乳腺癌,包括T-DXd联合卡培他滨、度伐利尤单抗+紫杉醇、capivasertib(AKT抑制剂)、阿那曲唑、氟维司群等5个模块。2022年ASCO大会报道了T-DXd+阿那曲唑和T-DXd+氟维司群的剂量探索结果。确定RP2D分别为T-DXd 5.4 mg/kg q3w+阿那曲唑1mg/天和T-DXd 5.4 mg/kg q3w+氟维司群500mg q4w(氟维司群负荷剂量为500mg,第一周期首次给药后第15天再给予500mg),结果同样显示总体的治疗耐受性和安全性良好。
DESTINY-Breast09:T-DXd冲刺一线治疗,正面挑战当前标准双靶方案
DB-09研究是探讨T-DXd用于HER2+晚期乳腺癌一线治疗的国际多中心、3期试验。入组患者是为接受过晚期化疗或抗HER2靶向治疗(允许仅接受过1线内分泌治疗)的HER2+转移性乳腺癌。患者随机分配治疗T-DXd单药治疗组、T-DXd+帕妥珠单抗治疗组,对照组则为当前标准治疗方案紫杉类+曲妥珠单抗+帕妥珠单抗(THP)。研究的主要终点是BICR评估的PFS,次要终点包括研究者评估的PFS、OS、研究者和BICR评估的ORR和DOR、研究者评估的二次无进展生存期(PFS2)等。该研究是第一个直接挑战THP一线标准治疗的3期研究,研究组T-DXd单药或联合帕妥珠单抗是完全不含化疗的方案。如果DB-09研究获得成功,将为HER2+晚期乳腺癌树立新的一线治疗标准。
DESTINY-Breast11:“去蒽环”乃至“无化疗”的T-DXd新辅助治疗方案
DB-11研究是探讨T-DXd用于HER2+早期乳腺癌新辅助治疗的3期研究,入组患者为HER2+早期乳腺癌(T0-4,N1-3,M0或≥T3,N0,M0),随机接受T-DXd单药治疗(A组)、T-DXd后序贯THP治疗(B组)、ddAC-THP治疗(C组),主要终点是病理完全缓解(pCR)率,次要终点是DFS、无侵袭性疾病生存期(IDFS)、OS。该研究的A组是T-DXd单药而B组则是以T-DXd替代蒽环,期待能够为临床提供毒副作用更小、疗效更好的“去蒽环”乃至“无化疗”的抗HER2新辅助治疗方案。
DESTINY-Breast12:T-DXd治疗脑转移患者,更大样本的3b/4期研究
基于在DB-01、DB-03研究,T-DXd已经获批用于经过抗HER2治疗的晚期HER2阳性乳腺癌相关适应证,这些研究均纳入了脑转移的患者,且显示T-DXd具有良好的颅内肿瘤控制效果。DB-12研究是一项探讨T-DXd用于接受过治疗且伴或不伴脑转移的晚期或转移性HER2+乳腺癌的上市后3b/4期研究。入组患者(n≈500)为接受过<2线抗HER2治疗的患者,其中队列1患者在基线时没有脑转移(n≈250),队列2在基线时有脑转移(n≈250),主要终点是队列1的ORR和队列2的PFS。该研究将为T-DXd治疗脑转移患者提供更大样本的信息。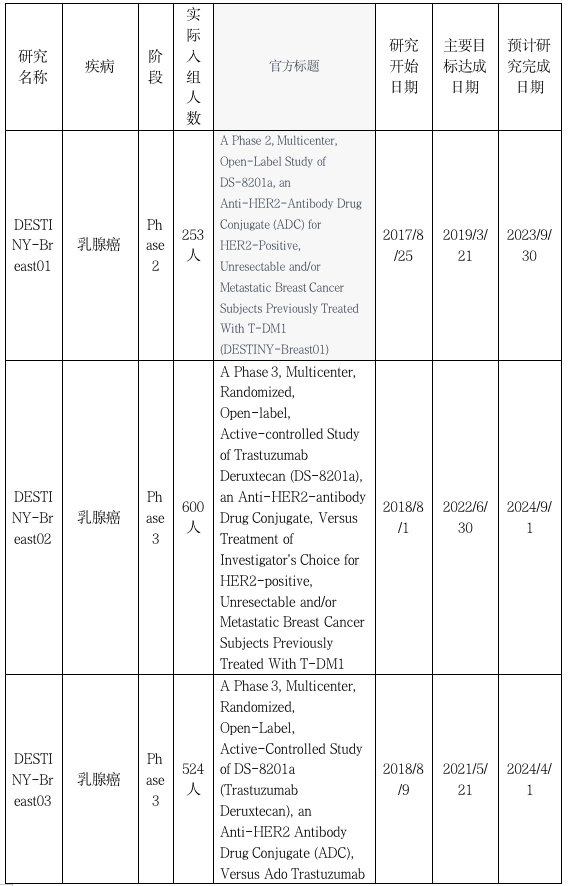


DESTINY -GASTRIC系列研究
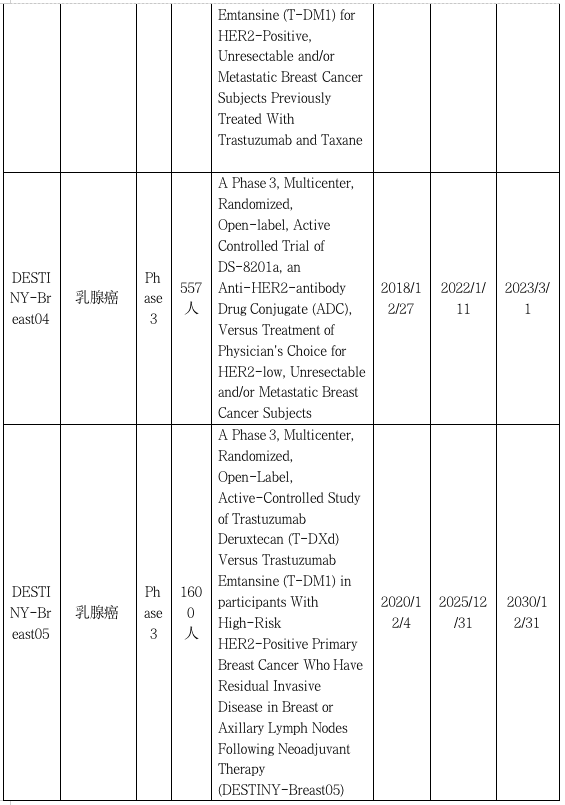
DESTINY -GASTRIC01:惊艳亮相,进入三线治疗梯队
II期DESTINY -GASTRIC01关键研究(NCT03329690) 评估了HER2阳性的晚期胃癌患者T-DXd与化疗的比较。在接受至少两种先前治疗(包括曲妥珠单抗)时出现进展 HER2 阳性胃或胃食管交界处腺癌的患者以 2:1 的比例随机分配接受 T-DXd 或化疗。在187名接受治疗的患者中,125人接受T-DXd治疗,62人接受化疗(55人接受伊立替康治疗,7人接受紫杉醇治疗)。T-DXd治疗组的ORR为51%,而医生选择化疗组的ORR为14%。总体生存期(OS) T-DXd组比化疗组长四个月(12.5比8.4个月)。
DESTINY -GASTRIC02:奠定胃癌二线治疗新格局
DESTINY -GASTRIC02 研究是T-DXd的另一项开放标签、单臂Ⅱ期研究,纳入一线含曲妥珠单抗治疗后进展的HER2阳性不可切除或转移性胃及胃食管交界处腺癌(以下简称晚期胃癌),评估T-DXd二线单药治疗在西方人群的疗效和安全性。主要研究终点为独立中心审查委员会(ICR)评估的ORR,次要研究终点包括ICR评估的无进展生存期(PFS)、OS、缓解持续时间(DoR)、安全性及PRO。截至2021年8月,中位随访时间10.2个月,ICR确证的ORR为41.8%,其中5.1%的患者达到完全缓解(CR),36.7%的患者实现部分缓解(PR),39.2%的患者获得疾病稳定(SD)。确证的DCR为81.0%,中位DoR为8.1个月,中位应答时间(TTR)为1.4个月。中位OS为12.1个月,中位PFS为5.6个月。经T-DXd二线治疗,HER2阳性晚期胃癌患者ORR高达41.8%、OS突破1年,是目前HER2阳性胃癌二线治疗方案中的最高记录;并且在治疗过程中HRQoL得以维持。进一步揭示了T-DXd二线治疗HER2阳性晚期胃癌的广阔前景。
DESTINY-Gastric03:探索联合治疗
DESTINY-Gastric03研究曲妥珠单抗deruxtecan(T-DXd)单独或与化疗和/或免疫疗法联合治疗HER2阳性晚期/转移性胃/胃食管交界处(GEJ)和食管腺癌患者的安全性、耐受性、药代动力学、免疫原性和初步抗肿瘤活性。研究以推荐的2期剂量对受试者进行T-DXd与细胞毒性化疗和/或免疫疗法的组合将显示出可控的安全性和耐受性以及初步的抗肿瘤疗效,以便进行进一步的临床测试。T-DXd与细胞毒性化疗或免疫检查点抑制剂联合应用于HER2阳性的胃、GEJ和食管癌症患者,这些患者之前未接受过晚期/转移性疾病的治疗,将初步证明其具有抗肿瘤活性,并有可能成为该患者群体的治疗选择。DESTINY-Gastric04研究将评估在HER2阳性(定义为免疫组织化学[IHC]3+或IHC2+/原位杂交[ISH]+)胃癌或GEJ腺癌在含有曲妥珠单抗的方案中或之后取得进展。参与者将以1:1的比例随机接受T-DXd或Ram+PTX治疗。主要目标是评估总体生存率。次要目标将进一步评估T-DXd的无进展生存率、客观反应率、反应持续时间、疾病控制率、安全性、药代动力学和免疫原性。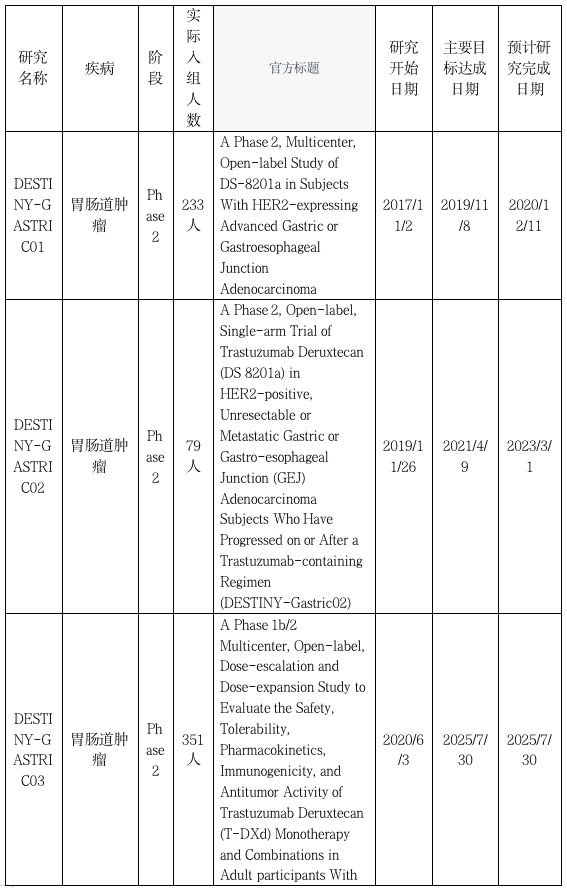
DESTINY-Lung系列研究
DESTINY-Lung01:FDA批准T-DXd用于HER2阳性非小细胞肺癌治疗
DESTINY-Lung01是一项开放标签、多中心、II期临床研究,旨在评估T-DXd治疗HER2过表达或HER-2突变的、经过标准治疗失败的NSCLC患者的疗效和安全性,主要终点为经ICR确认的ORR。研究结果显示,T-DXd的ORR高达54.9%, mPFS为8.2个月(95%CI,6.0-11.9),mOS为17.8个月(95%CI,13.8-22.1)。在DESTINY-Lung01研究中也评估了DS-8201在HER2突变的转移性NSCLC患者中的疗效和安全性。在91名入选患者中,55%的患者确诊OR,中位随访时间为13.1个月。中位PFS持续时间为8.2个月,中位OS持续时间为17.8个月。在46%的患者中观察到不良事件(3级以上),包括中性粒细胞减少症(19%)和贫血(10%)。临床观察也引起了人们对DS-8201潜在肺毒性的担忧。值得注意的是,在26%(91/23)的患者中观察到间质性肺病(ILD),两名患者死于治疗相关的ILD。ILD是一组影响肺间质的呼吸系统疾病,它会破坏我们身体的修复损伤过程并阻止氧气参与血液循环。因此,在后续临床试验中,需要更仔细地关注ILD,并对临床医生进行适当的培训,以识别和管理这种毒性作用。基于DESTINY-Lung01研究,FDA批准T-DXd用于HER2阳性非小细胞肺癌治疗
DESTINY-Lung02:FDA批准T-DXd(5.4mg/kg)用于HER2突变的晚期非小细胞肺癌患者后线治疗
DESTINY-Lung02研究是一项双盲、随机、Ⅱ期临床研究,主要目的是探索T-DXd 5.4mg/kg Q3W对比6.4mg/kg Q3W的疗效和安全性。主要研究终点是独立评审中心(BICR)评估的确认的客观缓解(cORR);次要研究终点包括BICR评估的持续缓解时间(DoR)、确认的疾病缓解率(cDCR)、安全性。截至2022年3月24日,预设早期分析队列PEC(随机分组后到截至数据截止日超过4.5个月的人群)中,5.4mg/kg 组纳入52例患者,6.4mg/kg 组纳入了28例的患者,70%以上的患者既往接受过免疫检查点抑制剂的治疗,随访时间都在5个月以上。疗效结果显示,5.4mg/kg 组cORR可达53.8%,6.4mg/kg 组为42.9%。安全性方面,5.4mg/kg组与6.4mg/kg组≥3级不良反应的发生率分别为31.7%和58%,6.4mg/kg组的不良反应发生率与DESTINY-Lung01研究一致。在临床最为关注的间质性肺炎(ILD)方面,5.4mg/kg组发生率仅5.9%,而6.4mg/kg 组发生率为14%,两组ILD多为1~2度,仅1例3度ILD,无4度发生。该研究结果是DESTINY-Lung01研究的有效延伸,提示通过降低T-DXd的剂量,可以在保持cORR的前提下,明显降低ILD及其他不良反应的发生。基于DESTINY-Lung02研究,2022年的8月FDA批准了T-DXd(5.4mg/kg)用于HER2突变的晚期非小细胞肺癌患者后线治疗,为临床提供了新的方案。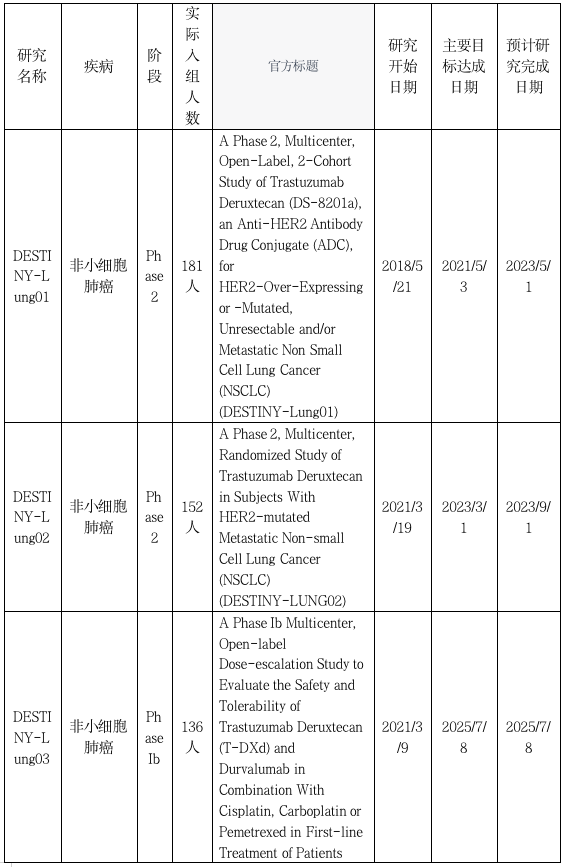

此外,DS-8201在结直肠癌、膀胱癌、胆道癌、宫颈癌、子宫内膜癌、卵巢癌、胰腺癌等多种实体瘤领域均有涉及和探索,我们期待未来进一步的临床结果。





















发表评论
注册或登后即可发表评论
登录注册
全部评论(0)