2023-09-05 来源 : 医药速览
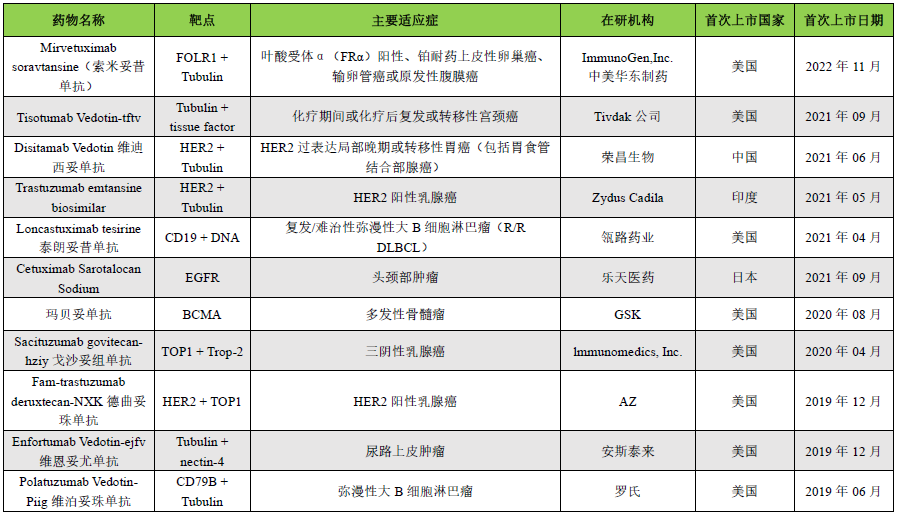
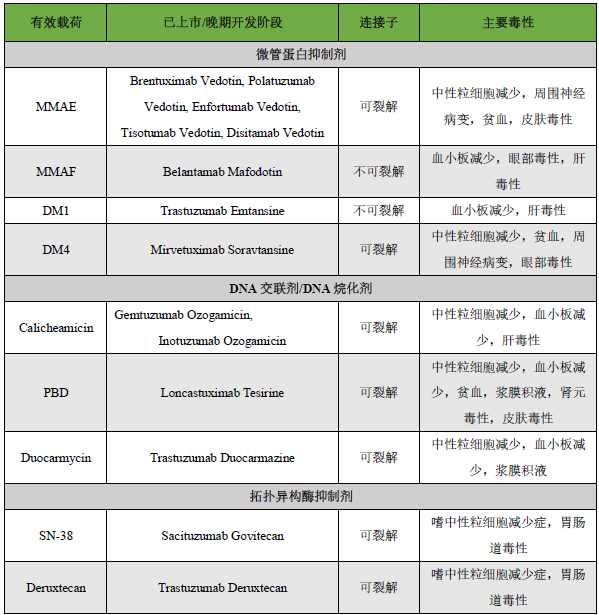
重点内容抢先看:近年来,抗体偶连药物(ADC)迅猛发展,截止至2023年8月,全球共有15款ADCs药物上市,超过1200条药物在研信息。今年6月,nature biotechnology发表了题为“ADCs’ revival”简讯,报导ADC在新药研发中的“破竹之势”。随着ADC药物在临床应用的深入,有些药物因表现出一定的毒副作用导致临床应用剂量减少或停止用药。还有一些ADC药物在上市申请过程中,因风险/获益比过大或对毒性的担忧而终止开发。本文总结了导致ADC药物毒性的机制,并尝试探讨提高ADC耐受性的策略。已上市ADCs药物汇总见下表。

在过去3年中,FDA审批的ADCs药物数量增加了2倍。在药物上市阶段,尽管一些ADCs已经证明了足够的有效性和安全性,但在临床应用过程中,几乎所有ADCs都表现出一定的毒性。对临床数据分析表明,剂量限制性毒性(DLT)因为相同的有效载荷,表现出相似的毒性。DLT通常与不表达靶向抗原的细胞和组织(即脱靶毒性)有关,并将ADC的剂量限制在最佳抗癌剂量水平以下。在本文中,回顾了导致ADC毒性的机制,总结了常见的ADC治疗相关的不良事件,并讨论可以减轻ADC毒性的方法。

据估计,ADC药物进入人体后,只有约0.1%的药物量被传递到靶向病变细胞群,绝大多数药物在非靶向健康细胞内分解“离位”,由此可能导致不必要的毒性。未到达靶病变或靶组织的ADC毒性可分为“靶上(on-target)”或“脱靶(off-target)”,即靶点介导的毒性通过ADC与健康细胞上的抗原蛋白结合。ADC的每个组成部分,包括抗体、连接子和有效载荷,都可能影响ADC诱导的毒性的程度。ADC的毒性作用机制见图1。
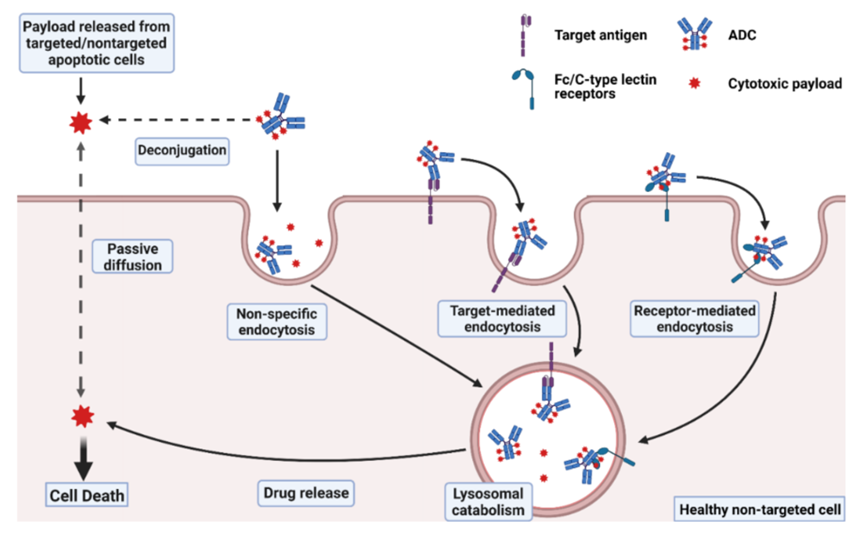
图1 ADC毒性作用机制(完整的ADC进入正常细胞可能通过非特异性内吞作用,或通过与靶抗原或Fc/C型凝集素受体结合而内化。细胞外液中的ADC分子解离的有效载荷或其他靶向/非靶向凋亡细胞释放的有效载荷可通过细胞膜被动扩散或非特异性内吞的方式进入正常细胞。
“Off-Target和Off-Site”毒性:理论上,ADC有望通过偶联技术,促使细胞毒性有效载荷靶向传递到目标细胞来提高治疗的选择性,同时减少有效载荷到非靶向的健康组织的传递,从而扩大治疗指数。在ADC药物开发早期,一直以为药物的毒性是由于正常组织会表达一定程度的靶抗原或肿瘤细胞与健康细胞中靶抗原的差异表达决定的。然而,随着ADC药物临床应用的深入,剂量限制毒性(DLT)很少由健康组织中的靶点表达驱动。回顾ADC药物IND申报数据发现,相同类别的链接子/有效载荷组成的ADC有高度相似的毒性特征,DLT和最大耐受剂量(MTD)。例如,含有甲基澳瑞他汀 E(MMAE)的ADC有相似的II期临床起始剂量(1.8 mg/kg至2.4 mg/kg)。含有MMAE的ADC均表现出相似的DLT(严重的骨髓毒性、脓毒症和严重的运动神经病变)。同样,在对2010年至2014年发表的临床ADC数据的回顾中,也发现与ADC相关的普遍3/4级毒性与有效载荷类别一致。例如,有效载荷为MMAE的ADC常见不良反应有严重贫血、中性粒细胞减少和周围神经病变。有效载荷为DM1的ADC,通常会观察到3/4级血小板减少和肝毒性,而MMAF和DM4的ADC均有严重的眼部毒性。类似于上述例子屡见不鲜。
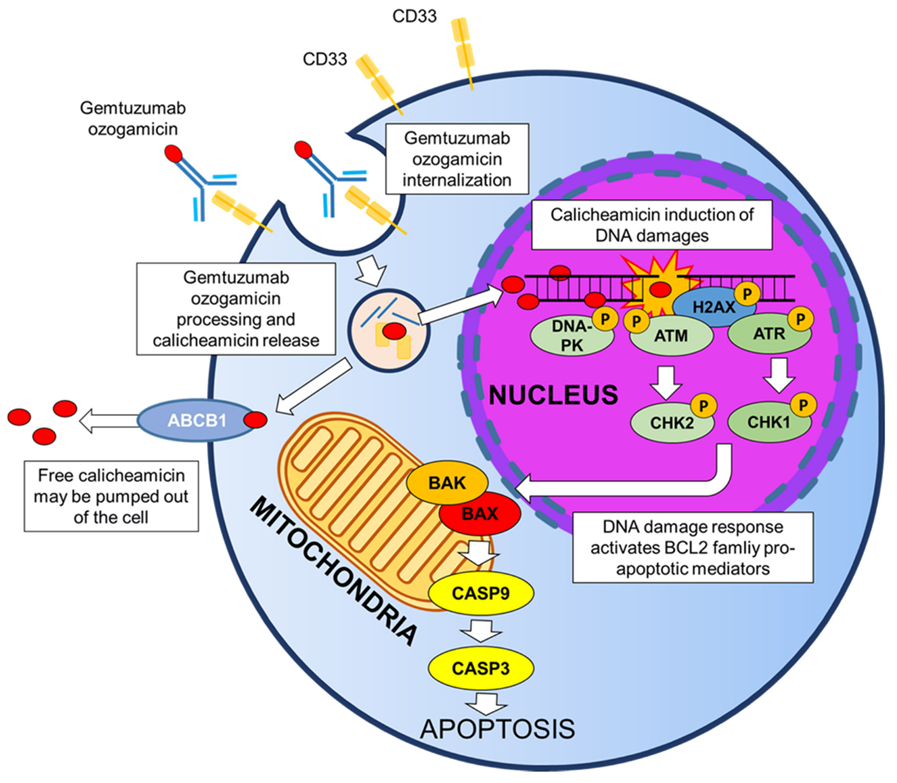
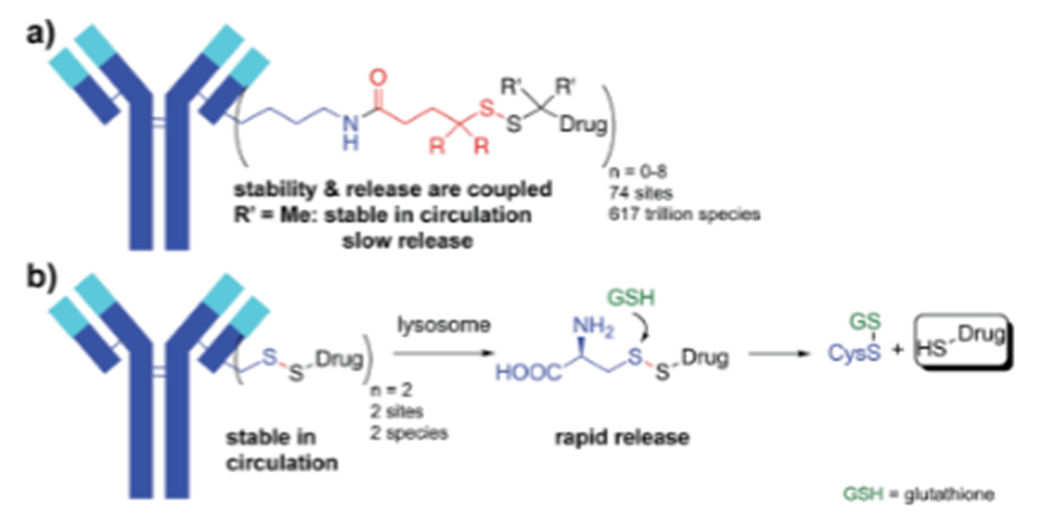
ADC有效载荷的脱靶:ADC给药后,释放的有效载荷迅速进入体循环,当然,也有部分有效载荷由于连接子的不稳定有关。连接剂主要有两类:可裂解的和不可裂解的。可裂解连接子旨在利用细胞内或肿瘤细胞外环境特有的微环境,在体循环中有良好稳定性。但在实践过程中发现,可裂解的连接子在血浆中可迅速裂解,导致有效载荷在到达靶组织前过早释放。亲脂性有效载荷通过质膜表现出高渗透性,因此,释放的有效载荷有效地进入非靶向细胞,可能导致细胞毒性。例如,第一代基于calicheamicin的ADC中使用的腙连接子将吉妥珠单抗与奥佐米星偶联,在细胞溶酶体的酸性环境中(即通过受体介导的内吞作用进入细胞)进行释放。然而,该连接体在血浆中快速水解,在ADC与靶抗原接触之前导致大量的有效载荷释放,并减少了传递到靶细胞的完整ADC的比例(作用机制见图2)。
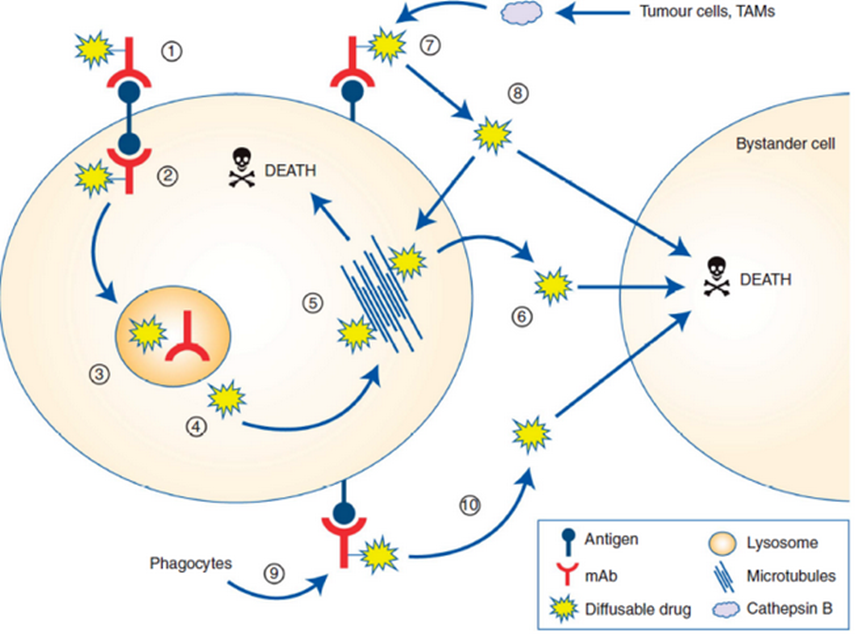
与可裂解连接子相比,不可裂解连接子在血浆中更稳定,但需要ADC进入细胞内,通过蛋白水解才能解离、代谢。这些代谢物通常由连接在抗体偶联氨基酸残基上的完整连接子有效载荷组成,如曲妥珠单抗-美坦新偶联物解离的赖氨酸-SMCC-DM1或belantamab mafodotin解离的半胱氨酸-MC-MMAF。这些代谢物通常带有电荷,细胞膜渗透性差。使用非可裂解连接子的ADC表现出较高的耐受性,这可能与释放的有效载荷脱靶毒性降低有关,但具有可裂解连接子的ADC通常表现出更好的疗效,其中的原因可能是由于旁观者效应((bystander cell)),即,肿瘤细胞周围的细胞(图3),包括异质性肿瘤细胞和上述的转移瘤细胞,这些附近的癌细胞可以是Ag+或Ag-的。而旁观者效应就是药物也能将这些细胞杀死。
除了释放的有效载荷通过质膜被动扩散进入非靶向细胞外,完整ADC的非特异性内吞作用也可能有助于有效载荷的off-site传递。非特异性的内吞作用可能受到ADC疏水性和电荷的影响。由于ADC平台中使用的大多数药物连接子是高度亲脂性的,ADC的疏水性通常与药物载量成正比(即药物-抗体比,DAR)。Hamblett等人的一项研究中,对几种含有2、4和8的抗CD30-vc-MMAE ADC进行了体内药代动力学、药效和毒性评估。与DAR值较低的ADC相比,DAR值较高的ADC具有更快的全身清除率,且耐受性较低、治疗指数较窄。同样,Sun等人证明,与DAR低于6的ADC相比,DAR为10的甲烷共轭ADC的清除率高5倍,体内疗效和耐受性降低。与DAR大于5.5(体重减轻7-9%)相比,低DAR ADC(2和3.5)治疗的小鼠体重减轻较轻(体重减轻约为4%)。此外,他肝脏中DAR较高的ADC分布显著升高,可能是由于Kupffer细胞和肝窦内皮细胞的非特异性摄取有关。
带正电荷的分子通常由于离子吸引到带负电荷的细胞膜而增加了电荷介导的内吞。多项临床前研究表明,IgG抗体的血浆清除率和组织分布与其等电点(pI)相关。例如,有研究表明,与中性或带负电荷的抗体相比,带正电荷的抗体在小鼠肝脏和脾脏中表现出较高的摄取,血浆暴露减少。
脱靶受体介导的ADC摄取:作为免疫系统的一部分,IgGs通过抗体恒定(Fc)域与免疫细胞表面表达Fc的受体相互作用,与不同类型的免疫细胞进行信号传导。与IgG相互作用的主要Fc受体类型之一是Fcγ受体(FcγR)。与Fc结构域结合可能导致免疫细胞中ADC的靶向非依赖性摄取和毒性。据研究表明,FcγRs可能与赫赛莱(T-DM1)治疗相关的血小板减少症有关。血小板减少被认为是一种非靶点依赖毒性,因为血小板和血小板形成巨核细胞(MKs)没有T-DM1的靶点HER-2的表达。T-DM1对成熟的MK影响最小,同时被内化,在分化来自人骨髓的MK时表现出强大的细胞毒性。脱靶毒性似乎是通过FcγRIIa介导的,阻断FcγRIIa结合可以抑制T-DM1的摄取。间质性肺病(ILD)/肺炎是与抗HER2 ADC治疗相关的普遍危及生命的不良事件之一。然而,ADC诱导的ILD的潜在原因目前尚不清楚。在最近发表的一项研究中,Kumagai等人证实了曲妥珠单抗在肺泡巨噬细胞中的分布较多,鉴于肺泡巨噬细胞表达过量的FcγR,且肺泡低表达HER2,Fc介导的非特异性摄取可能有助于ADC诱导的ILD。对去除FcγR结合的ADC研究可能有助于确定FcγR在ADC诱导的ILD中的作用。
除FcγRs外,甘露糖受体(MR)结合和受体介导的内化也是介导ADC脱靶肝毒性的潜在机制。受体介导的MR摄取是关键清除机制之一。例如,在人体中,具有高水平甘露糖基化作用的治疗性IGg的全身清除速度明显快于正常的IGg。Kogelbegs等人证实了MR介导的肝窦内皮细胞(SECs)对甘露糖化抗体酶融合蛋白MFECP1的摄取。MR抑制剂甘露聚糖对MFECP1清除有明显抑制作用。此外,与ADC治疗相关的急性血小板减少症和窦性梗阻综合征(SOS)与肝脏SECs的变性和丢失有关。因此,MR介导的肝SECs摄取可能是ADC靶向非依赖性肝毒性的主要原因。
“Off-Site和On-Target”毒性:尽管有证据表明,有效载荷介导的脱靶机制导致大多数ADC毒性,但ADC与健康组织中表达的靶抗原的结合也可能导致显著的毒性。例如,40%的患者在使用恩诺单抗(enfortumab vedotin)会出现味觉障碍,这是由于ADC靶点(nectin-4)在唾液腺中的表达导致的,事实上,这种毒性在使用其他已批准的MMAE-ADC治疗的患者中并不常见。如上示例所示,ADC产生的毒性与有效载荷无关。反之亦然,用不同有效载荷构建的ADC表现出相同的毒性,由此也可推断出该毒性是靶点介导的。
值得关注的是,应用相同的ADC来治疗不同的肿瘤可能会导致不同的毒性。例如,严重皮疹是Glembatumumab vedotin (CDX-011)的剂量限制毒性之一,这可能是与靶点gpNMB在皮肤中表达相关。在给予相同剂量的CDX-011后,4%的晚期乳腺癌患者出现≥3级皮疹,而晚期骨髓瘤患者出现率高于30%。瘙痒和脱发在黑色素瘤患者中发生率也高于乳腺癌患者(分别为63%和65%和21%和25%)。这一现象背后的机制尚不清楚,但可能与这两种肿瘤对健康细胞中gpNMB表达有关。在另一个例子中,LOP628,一种抗KIT-SMCC-DM1的ADC,在一些患者中引起了危及生命的快速过敏反应(HSR),导致终止临床开发。HSR的主要原因是由于抗KIT单克隆抗体共同参与KIT和FcγRs,引起肥大细胞脱颗粒。由于这种特殊的情况提出了一种独特的机制,即靶点介导的毒性不涉及对抗原表达细胞的相关毒性,而是通过共刺激信号通路激活免疫系统来发挥作用。此外,靶细胞抗原在健康组织中的表达并不总会导致靶细胞毒性。例如,膜相关粘蛋白MUC16在人眼表上皮中表达;然而,在临床试验中,使用抗MUC16 MMAE-ADC治疗的患者没有发生眼部毒性。TROP-2在各种组织中广泛表达;然而,sacituzumab-govitecan(戈沙妥珠单抗),一种结合了抗TROP2 SN-38的ADC,其临床毒性特征与SN-38有效载荷的临床毒性特征基本相似,提示其毒性机制可能由脱靶造成。戈沙妥珠单抗的低靶标毒性可能与:(1)与肿瘤相比,非恶性组织中TROP2表达量有限;(2)由于其表达不足,无法诱导毒性反应;(3)与肿瘤组织相比,正常组织对SN-38有效载荷的敏感性较低。此外,由于戈沙妥珠单抗使用pH敏感连接子,在酸性环境中释放有效载荷,相对于肿瘤,在正常组织的细胞外液中pH较高,这可能也是导致该ADC低靶点介导的毒性原因之一。

ADCs临床毒性分析
ADC相关的剂量限制性毒性
中性粒细胞减少:中性粒细胞占粒细胞的40%至70%,是先天免疫系统的重要组成部分,中性粒细胞通过造血干细胞的分化在骨髓中快速产生(大约每天1011个细胞)。它们的血液循环半衰期相对较短(大约一天)。与其他寿命较长的骨髓细胞,包括血小板(8天)和红细胞(120天)相比,这些独特的特征使中性粒细胞更容易受到抗肿瘤药物的影响。骨髓中造血细胞分裂的中断往往导致中性粒细胞的减少,并导致对严重感染。严重中性粒细胞减少是一种常见的剂量限制毒性,与大多数使用缬氨酸-瓜氨酸可切割连接物子MMAE-ADC相关,包括brentuximab vedotin(维布妥昔单抗)、polatuzumab vedotin(Polivy®)、enfortumab vedotin(PADCEV)和tisotumab vedotin(Tivdak™)。
ADC相关的中性粒细胞减少与累积血浆暴露于释放的有效载荷相关。具有细胞膜通透性的有效载荷很容易分布到骨髓和分化的造血细胞中。骨髓室细胞外液中完整ADC的解离也可能导致骨髓毒性,因为分化的中性粒细胞分泌丝氨酸蛋白酶,可以切割ADC连接子。除了上述脱靶机制外,靶点依赖机制也可能有助于靶向白血病抗原的ADC的中性粒细胞减少。在最近的一项系统分析中,Haubner等人量化了白血病干细胞的表达。其中一些基因,包括CD33、CD123和CLL-1,不仅在白血病干细胞中有高表达水平,而且在正常的造血干细胞/祖细胞中也有高表达水平,而CD33、CD123和CLL-1是中性粒细胞产生的前体。
血小板减少(症):血小板减少症是一种常见的脱靶毒性,与利用稳定连接子(SMCC-DM1或mc-MMAF)的ADC以及DNA交联有效载荷calichamicin有关。例如,99%的急性髓系白血病患者和42%的接受吉妥珠单抗奥唑米星治疗的急性淋巴细胞白血病患者发生≥3级血小板减少。据报道,14.5%接受trastuzumab emtansine治疗的乳腺癌患者和21%接受belantamab mafodotin治疗的多发性骨髓瘤患者出现≥3级血小板减少。
血小板减少症的确切机制尚不清楚。通过FcγR介导或微胞吞作用途径分化巨核细胞时,ADCs的非特异性摄取可能的原因之一。然而,ADC相关血小板减少的临床表现通常发生在24 h内,明显短于血小板8-10天的寿命。事实上,Guffroy等人表明,以卡奇霉素为基础的ADC,给予食蟹猴3天后表现出窦上皮细胞损伤,肝窦内血小板明积累,这与血清中血小板减少相吻合。
周围神经病变:周围神经病变的临床表现包括感觉相关症状,如四肢麻木、刺痛和四肢疼痛,或在较小程度上,运动相关症状,如肌肉无力。周围神经病变是一种常见的毒副作用,与接受微管蛋白抑制化疗药物相关。类似地,周围神经病变是一种剂量限制脱靶毒性,与ADC利用微管蛋白抑制剂有效载荷连接可分裂的连接物,如vc-MMAE、SPP-DM1和SPDB-DM4相关。周围神经病变的机制是体循环释放游离有效载荷引起的轴索性周围神经病有关。尽管外周神经元没有显著增殖,但功能性微管对蛋白质从细胞体运输到远端突触至关重要。因此,通过微管蛋白抑制有效载荷破坏微管可能导致周围神经病变。
眼毒性:眼毒性是含有SPDB-DM4连接子-有效载荷的ADC关键脱靶剂量限制毒性之一,如cantuzumab ravtansine、mirvetuximab soravtansine、coltuximab ravtansine,或者含有mc-MMAF 的ADC, 如belantamab mafodotin、AGS-16C3F、SGN-75。眼睛对ADC细胞毒性的易感性可能是由于眼部充足的血液供应,快速分裂的上皮细胞群的存在,以及靶点在眼部的高表达有关。在临床应用中,ADC相关的眼部不良事件的症状包括视力模糊、角膜炎、干眼症和微囊性上皮损伤。与aADC相关的眼部毒性的机制目前尚不清楚。也有专家认为通过大胞吞作用对完整ADC的非特异性摄取是ADC脱靶眼毒性的机制。下表总结了与ADC治疗相关的常见剂量限制毒性。
含有抑制有丝分裂有效载荷ADC的高损耗率是导致临床试验毒副作用的主要原因。往往剂量的升高,在增加毒副作用的同时,疗效也有所提高。但升高剂量,危及生命的发生率增加,临床开发受到一定限制。例如,vadastuximab talirine,CD33 PBD-ADC,在AML患者中达到了70%的完全缓解率;然而,由于发生了一些与治疗相关的致命事件,vadastuximab talirine的临床开发已终止。FDA的一项分析发现,2013年至2017年间,针对PBD偶联的ADC,47%的新药申请已经停止,其原因主要是出于安全考虑。这些结果表明,由于ADC的毒副作用,使其临床应用的剂量低于有效剂量,从而限制了ADC的临床开发。
有效载荷/连接子偶联技术:采用传统的氨基赖氨酸残基或巯基半胱氨酸残基非特异性偶联方法导致DAR和疏水性具有较大的异质性。载药范围从无负载(DAR = 0)到高负载ADC(DAR≥6)。高负载的ADC在血浆中不稳定,并在肝脏中表现出较高的非特异性摄取率,导致脱靶毒性增加。随着技术迭代,已经开发出来DAR值较为接近的ADC。第一个位点特异性偶联策略是由Junutula等人开发的,通过定点偶联将有效载荷连接到抗体CH1结构域Ala114位置的半胱氨酸残基上。通过基因工程在抗体的特定点插入半胱氨酸残基,然后将将半胱氨酸的巯基(-SH)和毒素偶联,形成位点专一的抗体偶联药物。这种技术被称为Thiomab 定点偶联。
除了位点特异性偶联外,经修饰改良的连接子还可以改变ADC的疏水性,降低毒性。连接子聚乙二醇化增加了ADC的亲水性,从而提高了PK、耐受性和疗效。自裂解连接剂(self-immolative linker)的发展也提高了ADC的稳定性和耐受性。20世纪80年代初,Carl等人开发了paraaminobenzyloxycarbonyl(PABC)自裂解连接剂,用于前药设计。从那时起,PABC连接子被广泛应用于ADC,特别是MMAE偶联的ADC。ADC内化到靶细胞后,被溶酶体酶裂解,vc-PAB-MMAE连接子/有效载荷中的PABC间隔层经过级联分解反应,促进细胞内MMAE的释放。与早期可裂解连接子相比,vc-PABC连接子具有优越的等离子体稳定性和更好的毒性,如基于卡奇霉素的ADC中使用的pH敏感连接子或基于DM1的ADC中使用的含有二硫键连接子,该连接子技术已经取得了成功,在FDA批准的12个ADC中有4个基于MMAE-ADC使用该连接子。此外,PABC连接子也被用于基于PBD ADC的开发。最近,Pillow等人开发了复杂的自裂解连接剂,使细胞毒性有效载荷能够直接偶联到工程化半胱氨酸残基上(图4)。工程化半胱氨偶联可以使得细胞毒性载荷均匀分布在整个ADC。IgG类抗体含有8个半胱氨酸键,可以通过特异性工程获得DAR值为2-4的ADC类药物。辉瑞等多家公司都使用该技术作为ADC药物偶联方式。与传统ADC相比,这些ADC在临床前阶段显示出巨大的潜力和耐受性。与传统的肽-PABC连接子技术相比,该技术提高了PBD-ADCs的耐受性。传统的肽-ADC和自裂解二硫醚-ADC均表现出相似的体内效价。但就毒副作用而言,自裂解ADC在大鼠中MTD高达10 mg/kg,但用5 mg/kg剂量的肽-ADC干预的动物体重明显减轻。
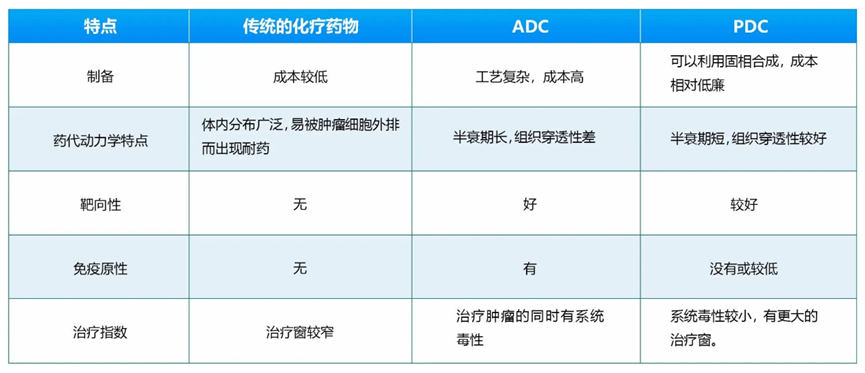
抗体修饰:由于大多数ADC的靶点在健康组织中也有一定程度的表达,ADC结合在这些组织中传递细胞毒性有效载荷可导致“on-target off-site”毒性。为了减少on-target毒性,多肽偶联药物(PDC)被开发出来,PDC与ADC有异曲同工之妙,但PDC则在某种程度上克服ADC的一些缺陷。与ADC药物相比,PDC药物分子量更小,具有更好的组织穿透性,没有免疫原性或较低;另外与抗体复杂的生产工艺相比,PDC更易合成、纯化和鉴定,成本也较低。近年来,随着环化技术、噬菌体展示技术和mRNA展示技术应用于靶向肽的筛选, PDC药物的开发迎来了加速发展。PDC有望成为继小分子靶向药、抗体药物、ADC之后的下一代靶向药物。PDC与传统化疗药物和ADC的比较见下表
优化给药方案:gemtuzumab ozogamicin最初于2001年被批准用于治疗CD33阳性AML,剂量为9 mg/m2,至少间隔两周。然而,在该给药频率与剂量水平下观察到严重毒性反应,包括血小板减少(99%)、中性粒细胞减少(97%)、≥3级高胆红素血症(23%)和≥3级丙氨酸转氨酶或天冬氨酸转氨酶水平升高,但疗效没有显著改善。因此,gemtuzumab ozogamicin于2010年退出市场。最近,引入了ADC的分级给药,患者在给药周期的第1、第4和第7天接受9 mg/m2剂量,超过3次3 mg/m2剂量,毒性反应更小。gemtuzumab ozogamicin的PK/PD分析表明,其毒性是由峰值血浆浓度(Cmax)驱动的,而其疗效是由暴露(AUC)驱动的。
总结
ADC 药物设计的本质是利用抗体的高选择性靶向运输能力将具有生物学效应的小分子药物,如细胞毒小分子药物高效地递送至病灶发挥治疗作用,既是一种新型药物分子,又是一种靶向递送系统。在这一体系内,抗体、链接体、小分子以及偶联技术等关键要素都需要作为一个整体来综合考虑,针对靶点的生物学特征以及疾病的特性和机理,选择合适的组件和技术对于开发成功的ADC药物至关重要。为了进一步发掘ADC药物的潜力国内外在各个关键要素上都正在进行大量的研究为开发新一代的ADC药物持续充实工具库,并提供源源不断的新思路。这些新思路包括:选择靶向肿瘤微环境的抗体并结合使用细胞外释放机制的链接体药物,解决靶点相关的耐药性;使用分子质量较小的抗体片段或者纳米抗体开发ADC,提高脑瘤组织穿透力;选择亲水性更好的链接体改善ADC的载药量和理化性质: 使用不同作用机制的小分子药物,降低毒副作用并拓展ADC药物的应用领域:选择定点偶联技术改善载药均一性和药代动力学特性等。相信在ADC 领域研究者的共同努力下,克服现有 ADC的缺点和挑战,下一代的ADC药物将会给肿瘤的靶向治疗带来新惊喜,使更多的肿瘤患者获益。另外,作为一种递送系统相信将来ADC药物必将用于更加广泛的领域,如中枢神经疾病、遗传疾病和感染性疾病等领域,作为真正高效的“魔法子弹”去消灭疾病,拯救生命。
参考文献:
D. T N,M. B
B,P. J B. Mechanisms of ADC Toxicity and Strategies to Increase ADC
Tolerability[J]. Cancers,2023,15(3).
Michele G,Giorgia S,Alessandra S, et al. Therapeutic Targeting of Acute
Myeloid Leukemia by Gemtuzumab Ozogamicin[J]. Cancers,2021,13(18).
H A S,P M B. Antibody drug conjugates and bystander killing: is
antigen-dependent internalisation required?[J]. British journal of
cancer,2017,117(12).
Singh, A.P.; Sharma, S.; Shah,
D.K. Quantitative characterization of in vitro bystander effect of
antibody-drug conjugates. J. Pharmacokinet. Pharmacodyn. 2016, 43, 567–582.
Chau, C.H.; Steeg, P.S.; Figg,
W.D. Antibody–drug conjugates for cancer. Lancet 2019, 394, 793–804.
多肽偶联药物(PDC)介绍及其药代动力学研究策略,药明康德
刘文超,李鸿峰,胡朝红.抗体偶联药物的技术现状和展望[J].生物化学与生物物理进展,2023,50(05):1167-1189.DOI:10.16476/j.pibb.2023.0141.
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)