2020-05-29 来源 : VIP说
肺癌发病率和病死率高居恶性肿瘤榜首。
免疫治疗在肺癌尤其晚期肺癌取得了革命性进展,已被指南推荐为一线治疗手段。免疫治疗的“长尾效应”使部分治疗有效的患者获得了超长时间的疾病缓解,不仅改善了生活质量,还实现了长期生存。
通常认为可手术就代表疾病可以治愈,早期肺癌患者真的就这么幸运吗?
其实不然,约50%早期肺癌患者在术后会出现复发甚至转移[1],迫切需要有效手段防止术后复发。各种临床探索均已尝试,但也只能将早期肺癌的5年生存率提高5%,相应的不良反应发生率也显著增高了[2]。
首先需要知道:
手术前使用叫做新辅助疗法;
手术后使用叫做辅助疗法;
围手术期使用叫做新辅助疗法+辅助疗法。
既然免疫治疗可使部分晚期肺癌患者长期获益,那早期肺癌患者如何呢?
答案是肯定的。
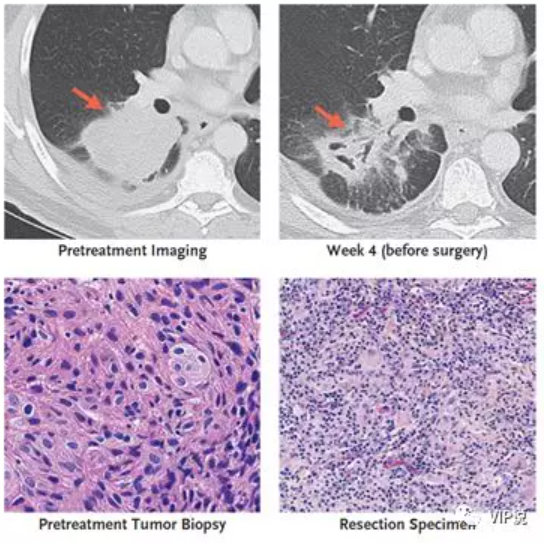
我们来看个病例,术前接受O药治疗后的早期肺癌患者,用药后肿瘤组织在影像学上发生了巨大改变,被明显破坏;病理上观察到肿瘤细胞明显减少,大量炎细胞浸润。
如果考虑使用PD-1,
是术前用(新辅助),还是术后用(辅助)呢?
是单药还是联合呢?
是免疫+化疗联合,还是免疫+免疫联合呢?
理论上免疫疗法的新辅助治疗可能更有优势,因为:
1、患者术前的身体状态相对较好,一方面可以更好的调动机体的免疫机能杀死肿瘤细胞,另一方面可以更好地耐受免疫治疗,延长治疗时间;
2、患者术前肿瘤的血供更完整,效应T细胞可更有效的到达肿瘤所在部位;
3、免疫治疗可在术前缩小肿瘤,降低手术难度,提高手术安全性,甚至给原本无法手术的患者手术的机会;
4、效应免疫细胞需要训练,学习如何识别肿瘤细胞,很重要的一点手术前患者的肿瘤还在,瘤体更大,异质抗原表达更多,免疫治疗可以充分调动体内抗肿瘤特异T细胞活性,杀灭肿瘤细胞;
5、免疫治疗可以清除微小转移灶,降低肿瘤复发风险;
如果术后再做免疫治疗,随着免疫微环境的变化,效果可能就不明显了。临床前期的动物实验也证实免疫治疗的新辅助治疗比辅助治疗效果更好[3]。我们来看看免疫治疗在早期肺癌新辅助都有哪些让人欣喜的数据。
1、CA209-159:单臂、开放标签研究,评估O药新辅助治疗可切除NSCLC的安全性及可行性。

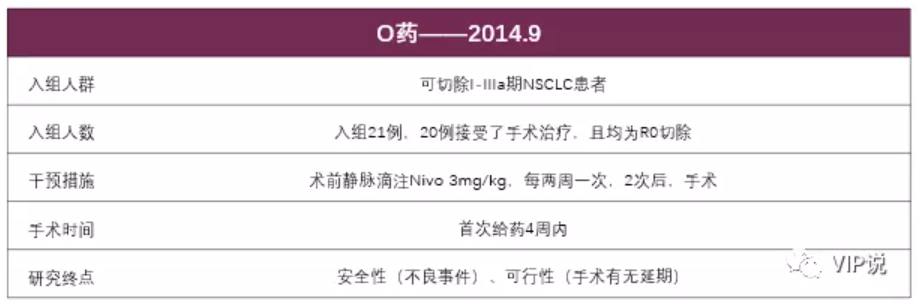
这是免疫治疗在NSCLC新辅助最早开展的研究,目前中位随访时间为34.6个月,1年无病生存率(DFS)达83%,尚未达到中位无复发生存期(RFS)和总生存期。主要病理学缓解率MPR(肿瘤细胞数<10%)达到45%。
未观察到围手术期患者死亡率及疾病复发率的增高,患者耐受性好,1例(4.8%)出现了与治疗相关的3级以上AE。
结论:新辅助治疗可切除I-IIIa期NSCLC患者不良反应率低,安全可行。免疫治疗的使用并不延误手术的实施,治疗前高TMB患者的MPR更高。
2、LCMC3(中期分析,数据截至2019年9月,摘要号8503):II期,单臂,多中心研究,评估T药新辅助治疗可切除NSCLC患者的有效性和安全性。
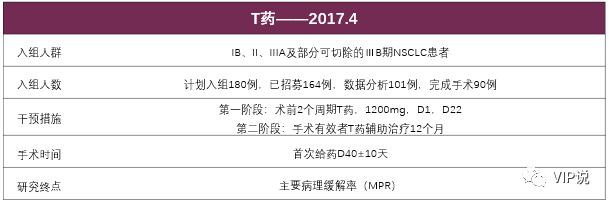
这是迄今为止样本量最大的新辅助免疫治疗研究,患者选择与临床需求相符,接近一半是III期患者,完全排除Ia期患者。
77例有效评估患者中, MPR为19%,病理完全缓解率(pCR)为5%。
PD-L1阳性组和阴性组的MPR分别为29%和8%,但以PD-L1 50%作为截断值,MPR则为35%和11%,具有统计学意义(P=0.04),高低TMB人群无明显差异。8例驱动基因阳性的患者,无一获得MPR。
完成手术的90例患者中,12个月DFS率为89%,1B期、Ⅱ期、Ⅲ期分别为90%、90%、87%。
术前治疗相关不良事件发生率54%,仅2例(2%)为≥3级;术前治疗免疫相关不良事件(irAE)发生率30%,其中仅1例(1%)≥3级;常见不良反应为乏力、发热、食欲减退、转氨酶升高等,安全性较好。
结论:T药新辅助治疗可切除NSCLC患者安全且有效;III期患者的1年DFS率达到了与I、II期患者十分接近的水平,病理缓解与肿瘤病灶大小的改变相关,与PD-L1表达水平、TMB高低无相关性;驱动基因阳性人群获益不多。
1、 NEOSTAR:II期随机对照开放研究,O药+Ipilimumab双免疫联合新辅助治疗可切除NSCLC。
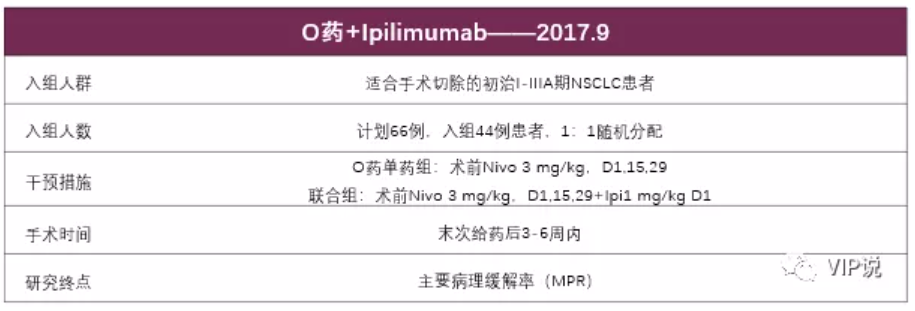
数据截至2019年5月8日,小样本随机对照研究对比O药单药与O药联合Ipilimumab双免疫新辅助治疗在可切除NSCLC患者中的疗效,研究筛选了53例患者,44例患者符合纳入治疗标准,23例接受O药单药治疗,21例接受双免疫治疗。
MPR为25% (单药组 vs 联合组:17 % vs 33%);
8例PR(单药组2例 VS 联合组6例),ORR 20%(单药组ORR为22% vs 联合组为19%);且ORR与MPR呈正相关(P<0.001)。
另外有两点值得关注的地方,
第一,亚组分析显示,PD-L1水平与ORR和MPR都有关,PD-L1表达越高,患者获益越多,与T药在LCMC3研究中的亚组分析结果不一致。
第二,双免疫治疗组的治疗效果更佳,更高比例患者未接受预期的手术方案(单药组23.8% vs 联合组8.7%)。
结论:双免疫联合较单药新辅助治的疗效更优,但还需III期临床试验验证。
1、 NADIM:II期单臂多中心研究,O药联合紫杉醇+卡铂新辅助治疗可切除IIIa期NSCLC。

这是首个在IIIa期NSCLC患者中探索免疫联合化疗疗效的多中心临床研究。
MPR高达85.36%(35例),pCR达71.4%(25例),93%的患者接受该新辅助方案后降期;影像学PR率达到72%(33例),CR率为6.5%(3例)。耐受性良好,无患者因出现PD或毒性等安全性问题出组。
结论:O药联合紫杉醇+卡铂新辅助治疗可切除III期NSCLC患者MPR达到新高度,18月PFS率>80%可能转化为OS获益。
目前研究已经初步证实了新辅助免疫治疗的安全性和耐受性,小荷才露尖尖角,虽然前景广阔,但也有几个问题值得深思:
1、MPR虽然是目前评估免疫治疗疗效的重要结局指标,似乎可以作为新辅助研究的主要研究终点,可预测OS,但能否转变为OS获益,仍需探索。
2、如何通过标志物筛选获益人群,目前是基于小样本的事后分析,结论不一致,还需进一步探索。
3、免疫单药治疗的安全性较好,但MPR的数据较低;而双免疫方案尽管可将MPR提高约10个百分点,但显著降低患者后续接受手术治疗的机会;免疫联合化疗的新辅助方式显示出更优的趋势。
4、目前多数免疫新辅助治疗的周期设定为2-3个周期,更多的是基于化疗新辅助的经验,缺乏循证医学证据的支持。
5、新辅助免疫治疗后,是否需要维持治疗?维持治疗多长时间?这些问题都有赖于进一步探索和解决。
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)