过往自己的知识储备只停留在表层,例如,PD-1的免疫刹车作用,与PD-L1相结合,化敌为友,这种粗浅的层面。而对于PD-1所牵扯的细胞信号通路,特别是PI3K-AKT通路,以及与之相关的一些细胞因子之间的关联,总是有畏难情绪,本文尝试梳理下自己的一些偶得,以飨读者。
1957年Isaacs和Lindenmann首先发现了病毒干扰现象,即病毒感染的细胞能产生一种因子,作用于其他细胞干扰病毒的复制,因而命名为干扰素。目前已知干扰素并不能直接杀伤病毒,而是诱导宿主细胞产生数种酶,干扰病毒的基因转录或病毒蛋白组分的翻译。根据产生干扰素细胞来源不同、理化性质和生物学活性的差异,可分为α-干扰素(interferon α, IFN-α)、β-干扰素(interferon β, IFN-β)和γ-干扰素(interferon γ, IFN-γ)。IFN是第一个应用于临床的基因工程产品,目前IFN-α、IFN-β、IFN-γ都有基因工程产物,40多个国家使用干扰素制剂,治疗30多种疾病,但主要用于临床肿瘤、病毒性感染等治疗。
IFN-α与PD-1联用治疗HCC
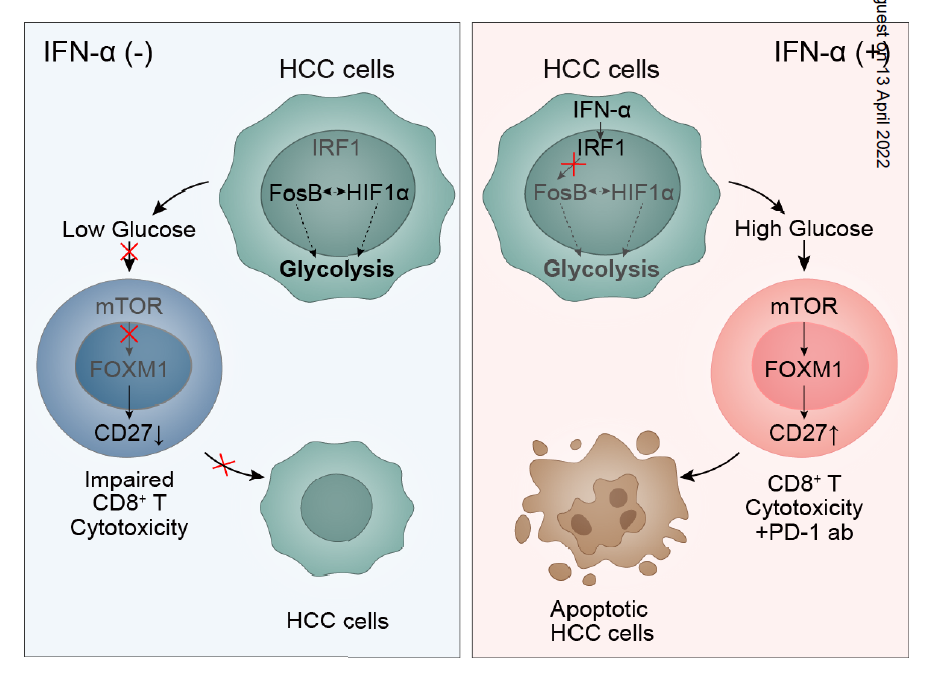
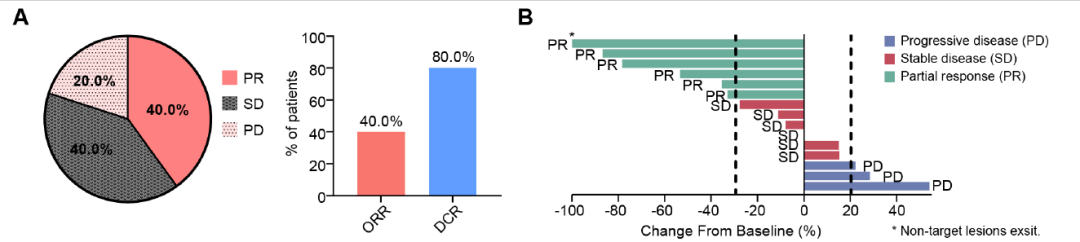
已有研究证实IFN-α和免疫检查点抑制剂联合用药的潜在抗肿瘤价值, 在Cancer Discovery期刊上发表了一篇研究,探讨了在HCC治疗中IFN-α提高PD-1抗体诱导的免疫应答的机制,证实IFN-α可通过糖代谢重塑肿瘤免疫微环境激活免疫应答,克服ICB耐药,并提出两者联合治疗肝癌的新策略。IFN-α与抗PD-1抗体协同作用导致细胞毒性CD27+CD8+T细胞显著富集。在机制上,IFN-α通过抑制HCC细胞中的FosB转录抑制HIF1α信号,导致葡萄糖消耗能力降低,从而建立一个高糖微环境,这是T细胞活化所必需的。并通过mTOR诱导T细胞中FOXM1的表达进而促进T细胞共刺激分子( CD27 )的转录与表达,从而提升CD8+T细胞的免疫杀伤能力。综上所述,这些数据表明,IFN-α在HCC肿瘤微环境中重新编程葡萄糖代谢,从而释放T细胞的细胞毒性能力并增强PD-1阻断诱导的免疫反应。IFN-α联合PD-1治疗不可切HCC的临床应答显著15例不可切除HCC患者接受IFNα和PD-1抗体联合治疗的ORR为40.0%(6/15),疾病控制率(DCR)达80.0%(12/15)(上图A-B),未发生与治疗相关的死亡。而且有两例经PD-1阻断失败的HCC患者,后经IFNα和PD-1抗体联合治疗后肿瘤体积显著缩小,并明显抑制肝癌肺转移。
IFN-α与抗血管生成抗体联用
尽管IFN-α和抗血管生成抗体在恶性肿瘤的治疗中显示出了一定的临床获益,但它们在临床应用上仍存在不足。在此之前,研究团队描述了一种名为JZA01的抗血管内皮生长因子受体2(VEGFR2)-干扰素α融合蛋白,与干扰素α相比,该融合蛋白在体内半衰期增加,副作用减少,并且比抗VEGFR2抗体对肿瘤的应答更有效。然而,融合蛋白的IFN-α组分与其受体IFNAR1的亲和力降低。为了解决这一问题,设计了一种与抗VEGFR2融合的IFN-α突变体,以产生抗VEGFR2-IFN α mut,用于靶向VEGFR2,从而增强抗肿瘤和抗转移效果。抗VEGFR2-IFN α mut特异性抑制肿瘤细胞增殖,促进凋亡。此外,抗VEGFR2-IFN α mut通过调节PI3K-AKT-GSK3β-snail信号通路抑制结直肠癌细胞的迁移和侵袭。抗VEGFR2-IFN α mut通过增强树突状细胞成熟、树突状细胞活性和增加肿瘤浸润CD8+T细胞,显示出优异的抗肿瘤疗效,改善了肿瘤微环境(TME)。因此,本研究为转移性结直肠癌的治疗提供了一种新的方法,该设计可能成为癌症免疫治疗的一种新方法。
PI3K/Akt 信号通路
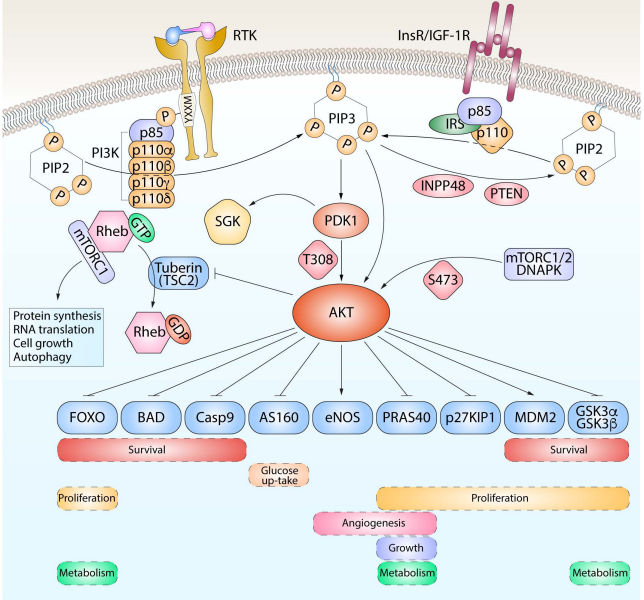
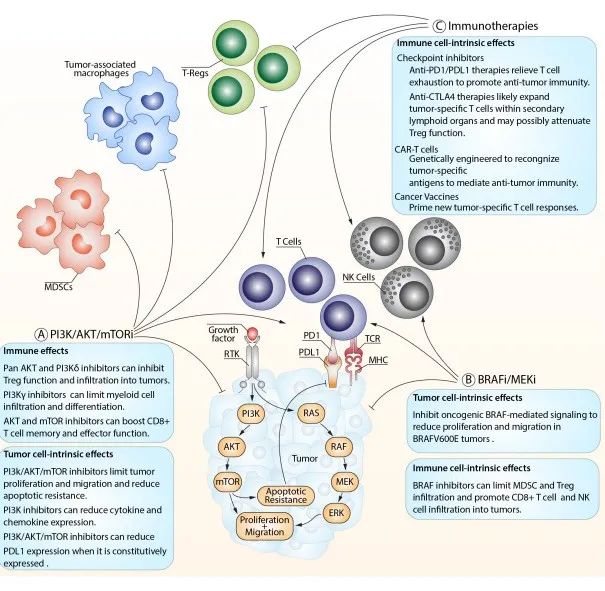
随着肿瘤精准治疗时代的到来,肿瘤研发的焦点之一是开发靶向疗法,抑制在许多癌症类型中失调的PI3K-AKT-mTOR信号通路。此外,现在人们越来越认识到,这些途径的靶向性不仅会影响癌细胞,还会影响宿主免疫力。PI3K-AKT途径是一种细胞内信号转导途径,响应细胞外信号,促进代谢、增殖、细胞存活、生长和血管生成。这一过程是通过一系列下游底物的丝氨酸或苏氨酸磷酸化介导的,涉及的关键基因是磷脂酰肌醇3-激酶(PI3K)和AKT/蛋白激酶b,所以这一通路直接用这两个基因命名。所以它们互作的过程就是这一通路的核心步骤。经研究表明PI3K-Akt信号通路在人类肿瘤谱中普遍失调,该通路某些因素的突变导致的功能获得或功能缺失,从而引起细胞转化,同时可调节肿瘤细胞的增殖和存活,并与肿瘤的侵袭转移行为密切相关。在肿瘤学研究中,PI3K-AKT-mTOR通路的靶向性,是潜在克服肿瘤复杂性和基因组异质性的机会点。本文的重点还是聚焦到前面IFN-α与免疫检查点抑制剂/VEGFR2抗体联用所聚焦的糖酵解途径。
在肿瘤微环境中,肿瘤细胞以极大的竞争优势从环境中摄取大量葡萄糖,保障其能量供应和自身生长,剥夺免疫细胞的葡萄糖利用并抑制其癌细胞杀伤效应。在低糖环境下,PKM2将磷酸烯醇式丙酮酸转化为丙酮酸,在肿瘤中高度表达,并促进肿瘤生长。有趣的是,在PKM2的作用下,HIF-1a识别结合PD-L1 promotor区,增强肿瘤细胞PD-L1的表达。免疫检查点PD-L1与B7-H3相互作用,在肿瘤细胞中激活了经典的有氧糖酵解途径PI3K-AKT-mTOR,同时因葡萄糖剥夺mTOR活性下调,在T细胞中糖酵解信号通路PI3K-AKT-mTOR被抑制。另外,CTLA-4途径竞争性地抑制CD28介导的共刺激,降低Akt磷酸化和活化,从而损害T细胞的糖代谢和线粒体重塑。而且,免疫检查点与其配体(如PD-1/PD-L1、PD-L2和CTLA-4/CD86)之间的相互作用会会抑制PI3K-Akt-mTOR途径破坏T细胞的代谢重编程。
1、Cancer Discov. 2022 Apr 12;candisc.1022.2021.
2、Acta
Pharm Sin B. 2021 Feb;11(2):420-433.3、Front Immunol. 2020 Mar 17;11:467. 版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。







发表评论
注册或登后即可发表评论
登录注册
全部评论(0)